Při úvahách, které se týkají popisu stavu soustavy a změn tohoto stavu, hraje významnou roli stavová veličina celková energie E soustavy a její změna. Celkovou energii soustavy tvoří:
Označíme-li součet prvních dvou složek celkové energie písmenem Em, pak lze psát
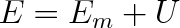 |
(2.1) |
V molekulové fyzice nebo v termodynamice se zpravidla nezabýváme mechanickým pohybem soustavy jako celku. Proto v dalších částech učebnice, nebu-de-li řečeno jinak, budeme pod pojmem energie rozumět vnitřní energii U.
Vnitřní energie U soustavy je energie, která závisí pouze na termodynamickém stavu soustavy a nezávisí na tom, jak se do tohoto stavu soustava dostala. Vnitřní energie patří mezi stavové funkce.
Z hlediska kinetické teorie látek je to energie, která závisí na charakteru pohybu a vzájemného působení částic, ze kterých se soustava skládá. Vnitřní energii tvoří:
Pokud uvažujeme děje, při nichž se nemění poslední dvě složky vnitřní energie (např. neprobíhají chemické reakce , ionizace, rekombinace a jaderné přeměny), postačí uvažovat vztah
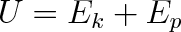 |
(2.2) |
Při zkoumání dějů, které probíhají mezi soustavou a okolím, resp. mezi tělesy tvořícími soustavu, nás většinou zajímá pouze změna vnitřní energie. Ta může nastat obecně dvěma ději: konáním práce a tepelnou výměnou.
a) Změna vnitřní energie konáním práce nastává tehdy, jestliže soustava koná práci, nebo vnější síly konají na soustavě práci. Příkladem je expanze (zvětšení objemu) nebo komprese (zmenšení objemu) plynu v nádobě s pohyblivým pístem, je-li nádoba adiabaticky izolovaná a uzavřená.
Vysvětleme uvedený příklad z hlediska molekulové fyziky. Při působení vnější tlakové síly F na píst (obr. 2-1 a) se částice plynu dopadající na pohyblivý píst odrážejí od něho s větší rychlostí než od pístu, který je vzhledem ke stěnám nádoby v klidu. Tím se zvětšuje střední kinetická energie částic plynu. Současně dochází ke zmenšení střední vzdálenosti částic, takže nastává i vzrůst celkové potenciální energie částic. Proto dochází při kompresi plynu ke zvětšení jeho vnitřní energie, což se projeví zvětšením teploty plynu.
Práce W vykonaná vnějšími silami na adiabaticky izolované a uzavřené soustavě při jejím přechodu ze stavu 1 do stavu 2 (obr. 2-la) je určena vztahy
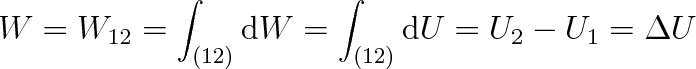 |
(2.3a) |
kde dU je elementární přírůstek vnitřní energie soustavy, U1 počáteční a U2 konečná hodnota vnitřní energie soustavy. Integrační cesta je označena (12). Protože je
 , tj. soustava přijímá energii od okolí, považujeme práci vykonanou okolím působícím na soustavu silami za veličinu kladnou (W > 0).
, tj. soustava přijímá energii od okolí, považujeme práci vykonanou okolím působícím na soustavu silami za veličinu kladnou (W > 0).
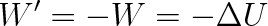 |
b) Změna vnitřní energie tepelnou výměnou. Pod pojmem tepelná výměna rozumíme děj, při kterém si částice jednoho tělesa vyměňují energii s částicemi druhého tělesa prostřednictvím vzájemných srážek v místě dotyku těles.
Tepelná výměna může také probíhat mezi dvěma tělesy, která se vzájemně nedotýkají. V tomto případě se přenos energie uskutečňuje tepelným zářením.
 Obr. 2-2
Obr. 2-2
Z energetického hlediska lze popsat tepelnou výměnu takto: Má-li těleso A na počátku děje vnitřní energie UA a těleso B vnitřní energii UB (obr. 2-2a) a po uvedení obou těles do vzájemného dotyku mezi nimi proběhne tepelná výměna (obr. 2-2b), pak na konci děje (po vytváření rovnovážného stavu soustavy) bude mít těleso A vnitřní energii U'A a těleso B vnitřní enegii U'B. Tvoří-li tělesa A a B izolovanou soustavu, pak podle principu zachování energie platí
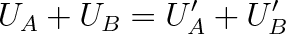 |
neboli
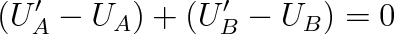 |
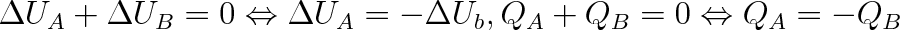 |
(2.4) |
Veličina QA resp. QB se nazývá teplo. Teplo je mírou změny vnitřní energie při tepelné výměně mezi dvěma tělesy (resp. mezi soustavou a okolím). Říkáme např., že během této výměny jedno těleso zvětší svou vnitřní energii o
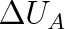 přijetím tepla QA , druhé těleso zmenší svou vnitřní energii o
přijetím tepla QA , druhé těleso zmenší svou vnitřní energii o
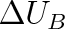 odevzdáním tepla QB , přičemž platí vztahy (2.4).
odevzdáním tepla QB , přičemž platí vztahy (2.4).
Pro rozlišení přijatého a odevzdaného tepla bývá užitečné označit teplo dodané soustavě písmeno Q (tj. soustava přijímá energii tepelnou výměnou) a teplo odevzdané soustavou písmenem Q' (tj. soustava odevzdává energii okolním tělesům tepelnou výměnou).