V kapalném skupenství mohou existovat jednak "čisté" látky, tj. látky o jedné složce, jednak roztoky. Některé čisté látky v kapalném skupenství (především kovy) jeví elektronovou vodivost, u většiny kapalin (hlavně u roztoků) se však projevuje vodivost iontová.
Elektronovou vodivostí kapalin se zabývat nebudeme. Pozornost obrátíme především na iontovou vodivost roztoků. Je známa skutečnost, že většina skutečně čistých rozpouštědel (voda, alkohol, benzen a další) jsou velmi špatnými vodiči. V některých případech však stačí rozpustit nepatrné množství vhodné látky, aby vodivost vzrostla o několik řádů. V tabulce 7.11 uvádíme některé typické příklady.
Tabulka 7.11 Příklady měrné vodivosti vybraných roztoků
|
látka |
měrná vodivost (sup>-1 |
teplota (K) |
|
voda (H2O) kyselina chlorovodíková (HCl) tetrachlormetan (CCl4) vodný roztok HCl (10-4 mol/litr) vodný roztok HNO3 (3.10-4 mol/litr) |
4 . 10-6 1 . 10-6 4 . 10-16 4 . 10-3 1 . 10-2 |
300 300 300 300 300 |
Látky, jejichž roztoky vedou elektrický proud, se nazývají elektrolyty. (Někdy se také elektrolytem rozumí příslušný vodivý roztok.) Zkušenost ukázala, že některé látky zvyšují vodivost značně, zatímco jiné velmi málo. Látky prvního typu se nazývají silné elektrolyty, látky druhého typu slabé elektrolyty. Mezi silné elektrolyty se řadí především soli anorganických i organických kyselin, a dále většina anorganických kyselin a zásad (HC1, H2SO4, HNO3, KOH, NaOH a jiné). Reprezentanty slabých elektrolytů jsou některé organické kyseliny (kyselina octová, kyselina mravenčí a další) a některé anorganické kyseliny a zásady (kyselina boritá, amoniak apod.). Kromě elektrolytů existují ovšem látky, které vodivost roztoků nezvyšují. Jako příklad tohoto druhu můžeme uvést vodný roztok alkoholu.
Zařazení dané látky do určité skupiny elektrolytů není ovšem absolutní; má smysl pouze ve vztahu k určitému rozpouštědlu. Výsledky experimentů totiž ukazují, že roztoky získané rozpouštěním stejného množství určité látky v různých rozpouštědlech mohou mít značně rozdílné vodivosti. Experimenty dále ukazují, že rozhodujícím kritériem schopnosti rozpouštědla vytvářet vodivé roztoky je jeho permitivita. Schopnost vytvářet vodivé roztoky roste s rostoucí permitivitou. Například voda (ε r = 80) má vysokou schopnost vytvářet vodivé roztoky, zatímco benzen C6H6 (ε r = 2,3) v podstatě vodivé roztoky nevytváří. Jelikož vodné roztoky patří k nejběžnějším a nejvíce prozkoumaným, budeme se nadále zabývat především jimi.
Uvedené základní experimentální údaje o vzniku vodivosti roztoků a zejména vlastnosti elektrolýzy, o níž bude řeč v následujícím článku, vedou k závěru, že nositele proudu v roztocích elektrolytů tvoří ionty elektrolytu. Je proto nutné předpokládat, že alespoň některé molekuly elektrolytu se v roztoku mohou rozštěpit na kladné ionty (kationty) a na záporné ionty (anionty). Toto štěpení molekul se nazývá elektrolytickou disociací. Studium vodivosti roztoků představuje jeden z velmi důležitých způsobů zkoumání jejích zákonitostí.
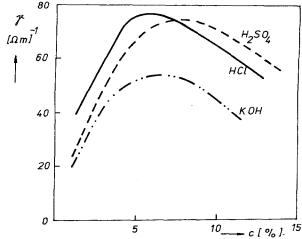
Měrná vodivost roztoků silně závisí na koncentraci. V oboru malých koncentrací vodivost s jejím zvyšováním vzrůstá, po dosažení určitého maxima pak dále klesá. Na obrázku 7.36 jsou uvedeny některé konkrétní výsledky.

Kromě měrné vodivosti se pro posuzování vlastností roztoků užívá tzv. molární vodivost, která číselně vyjadřuje měrnou vodivost roztoku, v němž na jednotkový objem připadá jeden mol částic realizujících vodivost. Označíme-li η molární koncentraci roztoku, tj. počet molů částic realizujících vodivost připadajících na l m3 roztoku, bude mezi měrnou vodivostí γ a molární vodivostí Λ platit vztah
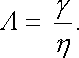 |
(7.42) |
Jednotkou molární vodivosti je tedy (>-1.m2.mol-1). Je třeba mít na paměti, že při udání molární vodivosti musí být vždy (například chemickým vzorcem) specifikován druh částic, na jejichž jednotkovou molární koncentraci se vodivost vztahuje. Nejběžnější je vztahovat molární vodivost na jednotkovou molární koncentraci chemických ekvivalentů.[66]
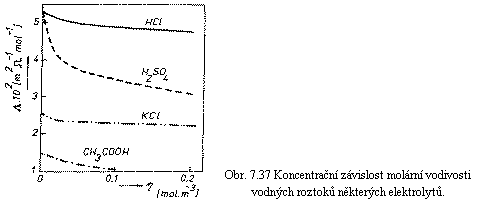
Z definice molární vodivosti vyplývá,
že by neměla být závislá na koncentraci roztoku, kdyby podíl všech molekul
elektrolytu na vodivosti roztoku byl na koncentraci nezávislý. Jak je však
vidět z obr. 7.37, který uvádí experimentálně zjištěné koncentrační
závislosti Λ
pro některé látky, molární vodivost s rostoucí koncentrací roztoku ve
skutečnosti vždy klesá. Tato skutečnost může být v principu vysvětlena
dvěma příčinami. Jednak se může se změnou koncentrace měnit stupeň disociace
elektrolytu, jednak může na koncentraci záviset schopnost pohybu nositelů
proudu. Ve skutečnosti se uplatňují oba mechanismy. První z nich nabývá převahy
u slabých elektrolytů (zejména v oboru nízkých koncentrací), druhý se naopak
uplatňuje především u elektrolytů silných. V článku 7.6.6 bude ještě těmto
otázkám věnována pozornost.
Pro studium fyzikálně chemických vlastností roztoků je důležitou veličinou hodnota molární vodivosti Λ ℜ nekonecno získaná extrapolací k nulové koncentraci. (Z historických důvodů se někdy nazývá molární vodivostí při nekonečném zředění.) Její význam spočívá v tom, že vyjadřuje schopnost jednoho molu daných částic vést proud v situaci, kdy lze zanedbat jejich vzájemnou interakci.
Je-li vodivost roztoku elektrolytu realizována několika typy iontů, je výsledná molární vodivost při nekonečném zředění rovna součtu molárních vodivostí realizovaných jednotlivými ionty. Tento poznatek vyjadřuje aditivnost molární vodivosti při nekonečném zředění. Byl formulován F. W. Kohlrauschem (v r. 1873) na základě výsledků jeho velmi systematických a přesných experimentů. Nazývá se proto Kohlrauschovým zákonem, někdy také zákonem nezávislého pohybu nositelů proudu v roztoku. Jestliže tedy v daném roztoku dva druhy nosičů proudu A a B vytvářejí molární vodivosti při nekonečném zředění Λ ℜ nekonecno ,A a Λ ℜ nekonecno ,B je podle Kohlrauschova zákona výsledná molární vodivost roztoku při nekonečném zředění Λ ℜ nekonecno rovna
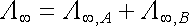 . . |
(7.43) |
Nyní budeme věnovat pozornost jevům, které vždy doprovází průchod proudu v látkách, má-li jejich vodivost iontový charakter. Tyto jevy, nazývané elektrolýzou, spočívají v chemických změnách v roztoku a na elektrodách, nastávajících při průchodu proudu. Elektrolýza může mít různé konkrétní formy závislé na materiálu elektrod a na typu elektrolytu. Tyto formy jsou podmíněny povahou fyzikálně chemických procesů probíhajících při styku elektrod s elektrolytem (rozpouštění materiálu elektrod, vylučování látek na elektrodách, různých chemických reakcí apod.). Konkrétní projevy vzájemné interakce mezi roztokem a elektrodami nás však budou zajímat až v příštím článku, kdy se budeme zabývat elektrochemickými procesy nehomogenních soustav. Nyní se omezíme pouze na formulování kvantitativního vztahu pro množství látky přenesené roztokem k určité elektrodě při průchodu proudu.
Tyto vztahy jsou vyjádřeny známými Faradayovými zákony elektrolýzy. První Faradayův zákon říká, že v případě, kdy se na uvažované elektrodě vylučuje pouze jediný druh látky, je její množství M úměrné prošlému náboji Q
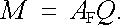 |
(7.44) |
Konstanta úměrnosti AF, charakteristická pro danou látku, se nazývá jejím elektrochemickým ekvivalentem. V soustavě jednotek SI bude elektrochemický ekvivalent vyjádřen v kilogramech na coulomb (kg. C-1).
Druhý Faradayův zákon vyjadřuje souvislost mezi množstvími různých látek vyloučených stejným nábojem Q. Jestliže dvěma roztoky různých elektrolytů projde týž elektrický náboj Q, bude poměr množství látek MA, MB, vyloučených na příslušných elektrodách, roven poměru jejich chemických ekvivalentů GA, GB. Tedy
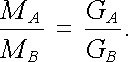 |
(7.45) |
Ze vztahu (7.45) vyplývá, že k vyloučení jednoho molu chemických ekvivalentů libovolné látky je zapotřebí vždy stejný náboj F, který se nazývá Faradayovým nábojem, (někdy též, Faradayovou konstantou). Jeho hodnotu, která má bezprostřední vztah k hodnotě Avogadrovy konstanty (viz. čl. 7.6.6), je třeba určit měřením. Dnes užívanou hodnotou je F = 96 485,3415(39) C.mol-1 (viz Dodatek 2).
Náboj procházející roztokem je zpravidla přenášen jak anionty, tak kationty. Pro studium chování jednotlivých typů iontů je užitečné znát podíl, kterým se na přenesení celkového náboje Q podílejí. Tento podíl se nejčastěji vyjadřuje relativně pomoci tzv. Hittorfových převodních čísel. Předpokládejme, že z celkového náboje velikosti Q prošlého roztokem byla část QA přenesena kationty a část QK přenesena anionty. Hittorfova převodní čísla aniontů a kationtů tA, tK jsou pak definována vztahy
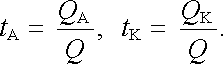 |
(7.46) |
Jelikož je ovšem Q = QA + QK, platí tA + tK = 1. Hittorfova převodní čísla jsou důležitými veličinami při studiu pohyblivosti iontů. Lze je určit měřením ze změn koncentrace elektrolytu v blízkosti elektrod, popřípadě z pohybu rozhraní mezi dvěma elektrolyty při průchodu proudu. Otázky tohoto druhu budou studovány v článku 7.6.6.
V tomto článku si krátce všimneme jevů, které nastávají v nehomogenních soustavách. Zejména budeme studovat elektrochemické procesy na povrchu elektrod ponořených do roztoku elektrolytu, které jsou doprovázeny působením vtištěných sil mezi elektrodou a roztokem.
Existence potenciálových rozdílů mezi elektrodami ponořenými do roztoku je známa od 2. poloviny 18. století. O objev toho jevu se zasloužili zejména L. Galvani a A. Volta (Volta také sestrojil první galvanický článek schopný trvale dodávat proud). Výklad jeho činnosti, který je založen na možnosti výměny iontů mezi elektrodou a roztokem, podal W. Nernst.
Každý kov ponořený do vody nebo do vodního roztoku má větší či menší tendenci se rozpouštět, podobně jako se ve vodě rozpouštějí například soli. Rozdíl je však v tom, že kov je tvořen krystalovou mřížkou složenou z kladných iontů, jejichž kladný náboj je kompenzován záporným nábojem volných elektronů. Při rozpouštění mohou do roztoku přecházet jen kladné ionty, takže kov se přebytečnými elektrony nabíjí záporně. Na druhé straně je nutné předpokládat existenci opačného procesu, kdy kladné ionty (kationty) přítomné v roztoku budou mít určitou tendenci zabudovávat se do krystalové mřížky elektrody. Přechodem těchto kationtů se bude naopak elektroda nabíjet kladně.
Na základě uvedených představ o chemické aktivitě mezi elektrodou a roztokem je možné kvalitativně pochopit, že za určitou dobu po vložení elektrody do roztoku nastane rovnovážný stav, při kterém si za jednotku času elektroda a roztok vzájemně vymění stejný počet iontů. Tato rovnováha bude ovšem obecně podmíněna existencí nenulového potenciálového rozdílu mezi elektrodou a roztokem. Skutečně, bude-li zpočátku převažovat například přechod kladných iontů z kovu do roztoku, bude se kov postupně nabíjet záporně a vzniklé elektrické pole bude znesnadňovat přechod dalších kationtů. Při určité hodnotě záporného napětí elektrody vůči roztoku se oba procesy vyrovnají a nastane zmíněný rovnovážný stav. V opačném případě, kdy zpočátku převládal přechod aniontů z roztoku na elektrodu, bude rovnovážný stav charakterizován určitým kladným napětím elektrody. Tato rovnovážná napětí mezi elektrodami a roztokem se ve fyzikální chemii nazývají elektrodovými potenciály. Jejich hodnoty i znamení závisí na materiálu elektrod i roztoku.
Elektrodový potenciál představuje důležitou fyzikálně chemickou charakteristiku dané látky. Bohužel však není možné určit jeho absolutní hodnotu, neboť měřitelné je pouze napětí mezi dvojicí elektrod. Proto se konstruují různé standardní elektrody a zavádí se pojem standardních elektrodových potenciálů. Standardní elektrodový potenciál dané látky je vlastně elektromotorické napětí článku, jehož jednu elektrodu tvoří zkoumaná látka, druhou zvolená standardní elektroda, přičemž roztok elektrolytu je určitým způsobem standardizován. Ze znalosti standardních potenciálů a určitých vlastností příslušných elektrolytů je pak možno vypočítat elektromotorické napětí libovolného článku s roztokem libovolné koncentrace.
Standardní elektrodové potenciály se často vztahují k tzv. standardní vodíkové elektrodě, která představuje nejdůležitější typ tzv. kationtové elektrody. Kromě ní se však ještě používá řada jiných typů elektrod. Popis jejich vlastností a konstrukce, stejně jako podrobnější výklad o vlastnostech elektrodových potenciálů lze nalézt v učebnicích fyzikální chemie (viz. např. [13,16]).
Na obrázku 7.38 je zobrazen princip uspořádání klasického, historicky významného Daniellova článku, na jehož příkladu budeme demonstrovat právě vyložené kvalitativní poznatky. Článek se skládá z nádoby rozdělené na dvě části průlinčitou přepážkou D (diafragmou). Jedna část nádoby je naplněna roztokem síranu zinečnatého (ZnSO4), v němž je ponořena zinková elektroda, zatímco druhá její část je naplněna koncentrovaným roztokem síranu měďnatého (CuSO4) s ponořenou elektrodou měděnou. Experiment ukazuje, že po ustavení rovnováhy bude mezi elektrodami napětí asi 1,1 V, přičemž měděná elektroda bude vůči zinkové kladná. Při spojení obou elektrod vnějším vodičem zjistíme, že článek je schopen udržet ve vzniklém obvodu proud.

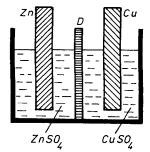
Toto chování článku kvalitativně snadno
vysvětlíme na základě představ uvedených v předchozím výkladu. Nechť
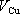 a
a
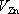 jsou příslušné elektrodové potenciály, tj.
napětí jednotlivých elektrod vůči příslušným roztokům v rovnovážném stavu
iontových procesů na jejich površích. Za předpokladu, že roztok v obou
částech nádoby má stejný elektrický potenciál φ
r
budou mít potenciály elektrod hodnoty
jsou příslušné elektrodové potenciály, tj.
napětí jednotlivých elektrod vůči příslušným roztokům v rovnovážném stavu
iontových procesů na jejich površích. Za předpokladu, že roztok v obou
částech nádoby má stejný elektrický potenciál φ
r
budou mít potenciály elektrod hodnoty
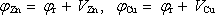 .
Napětí, které vytvoří elektrické pole mezi oběma elektrodami, pak bude mít
rovnovážnou hodnotu
.
Napětí, které vytvoří elektrické pole mezi oběma elektrodami, pak bude mít
rovnovážnou hodnotu
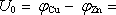
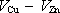 .
Při spojení elektrod vnějším vodičem budou účinkem tohoto pole přecházet volné
elektrony ze zinkové na měděnou elektrodu, čímž se ovšem zmenší napětí
.
Při spojení elektrod vnějším vodičem budou účinkem tohoto pole přecházet volné
elektrony ze zinkové na měděnou elektrodu, čímž se ovšem zmenší napětí
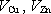 a poruší se rovnováha v iontových procesech
na elektrodách. Zinková elektroda bude opět získávat přebytek záporných nábojů
a měděná elektroda přebytek kladných nábojů. Vnějším vodičem poteče proud
tak dlouho, pokud zůstanou zachovány uvedené poměry uvnitř článku.
a poruší se rovnováha v iontových procesech
na elektrodách. Zinková elektroda bude opět získávat přebytek záporných nábojů
a měděná elektroda přebytek kladných nábojů. Vnějším vodičem poteče proud
tak dlouho, pokud zůstanou zachovány uvedené poměry uvnitř článku.
Právě vyložené
procesy uvnitř Daniellova článku přesně odpovídají situaci, o níž jsme
abstraktně mluvili v čl. 3.2.3 při zavádění pojmu zdroje elektromotorického
napětí. Napětí U0 je
zřejmě svorkovým napětím článku. Není-li z něj odebírán proud, můžeme položit U0 = E
. Elektromotorické napětí E
zde popisuje schopnost elektrodových procesů transportovat náboj určitým
směrem. V případě, že článek dodává proud do vnějšího obvodu, je hodnota
svorkového napětí určena vztahem
(3.33)
. Vnitřní odpor
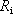 je v tomto případě odpor roztoku mezi
elektrodami. Výkon dodávaný článkem do vnějšího obvodu je určen vztahem
(3.48)
a je získáván na úkor vnitřní energie článku, která se při odběru proudu
uvolňuje v důsledku fyzikálně chemických dějů na elektrodách.
je v tomto případě odpor roztoku mezi
elektrodami. Výkon dodávaný článkem do vnějšího obvodu je určen vztahem
(3.48)
a je získáván na úkor vnitřní energie článku, která se při odběru proudu
uvolňuje v důsledku fyzikálně chemických dějů na elektrodách.
Charakter těchto dějů závisí na konkrétních vlastnostech dané soustavy. Může například docházet ke změnám koncentrace a složení roztoku u jednotlivých elektrod, nebo mohou na elektrodách probíhat určité chemické reakce, které změní jejich chemické složení. Podstané však je, že uvedené elektrodové procesy musí zabezpečovat kontinuitu proudu v obvodu. Vzhledem ktomu, že v elektrodách je proud realizován elektrony a v elektrolytu ionty, elektrodové procesy musí na jedné elektrodě zabezpečovat odčerpávání elektronů do elektrolytu a na druhé elektrodě předávání elektronů z elektrolytu.[67]
Uvedené chemické změny mohou obecně vyvolat změny elektrodových potenciálů obou elektrod, a tím také změny proudu protékajícího soustavou. Tento jev, který je obecným průvodním jevem elektolýzy, se nazývá polarizace elektrod. Projevuje se tak, jako kdyby v průběhu elektrolýzy započal v obvodu působit nový zdroj tzv. polarizačního elektromotorického napětí E p . Na základě energetických úvah lze ukázat, že polarizační elektromotorické napětí musí vždy působit zmenšení proudu, který je vyvolal. Musí tedy mít vždy opačné znamení něž původní elektromotorické napětí, jehož účinkem začala v obvodu probíhat elektrolýza.
K polarizačním jevům je nutné přihlížet při konstrukci článků, které mají sloužit jako v praxi upotřebitelné zdroje elektromotorického napětí. Takové články je nutné konstruovat tak, aby produkty elektrolýzy, vznikající při činnosti článku, nemohly pokud možno vytvářet polarizační elektromotorické napětí.
V Daniellově článku dodávajícím proud do vnějšího obvodu probíhá na záporné zinkové elektrodě anodická reakce
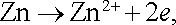 |
zatímco na kladné měděné elektrodě probíhá reakce katodická
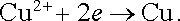 |
Diafragma v Daniellově článku do určité míry zabraňuje smíchání kationtů z jednotlivých částí nádoby. Kdybychom mohli předpokládat, ze při provozu článku nedochází k průchodu kationtů diafragmou, byla by probíhající elektrolýza charakterizována pouze rozpouštěním zinkové elektrody a usazováním měďnatých iontů na elektrodě měděné. Chemické složení elektrod by se tedy neměnilo a polarizační napětí by bylo dáno pouze změnami koncentrace roztoků. Ve skutečnosti není tento předpoklad nikdy ideálně splněn. Ve zcela vybitém článku jsou všechny měďnaté ionty vyloučeny na kladné elektrodě a elektrolyt je tvořen jen chloridem zinečnatým. Daniellův článek má malou životnost a s ohledem na dnešní potřeby není použitelný.
Galvanické články, které se v praxi používají, lze rozdělit do dvou skupin. Do první skupiny zařazujeme primární (nevratné) články, které mají jednorázové použití. V důsledku elektrolýzy probíhající při odběru proudu (tzv. vybíjení) dochází v těchto článcích k nevratným procesům, kterými se články postupně znehodnocují. Do druhé skupiny zařazujeme sekundární (vratné) články, nazývané také akumulátory, které je naopak možné průchodem proudu opačného směru (po připojení k vnějšímu zdroji) přivést do původního stavu; mluvíme o nabíjení článku.
Užitnou hodnotu galvanického článku určuje řada parametrů. Mezi nej-důležitější patří kapacita článku (obvykle udávaná v ampérhodinách) vyjadřující celkový náboj, který může článek do v nějšího obvodu dodat, dále hustota enegrie (udávaná ve watthodinách/litr), vnitřní odpor, maximální pracovní proud, rychlost samovolného vybíjení (udávaná v procentech kapacity za den) a jiné. S rostoucí spotřebou galvanických článků, zejména pro mobilní elektronická zařízení, nabývají stále větší význam i ekologická hlediska, především obsah toxických materiálů. V následujícím textu uvedeme stručnou charakteristiku nejdůležitějších typů.
a) Primární články
Pro laboratorní účely má stále největší význam Westonův článek, jehož katodu tvoří amalgam kadmia, anodu rtuť a elektrolyt nasycený roztok síranu kademnatého CdSO4 a který se uplatňuje jako normál elektromotorického napětí. Podrobnější popis jeho konstrukce a vlastností je uveden v [5]. My zde uvedeme pouze, že jeho elektromotorické napětí E W = 1,01865 V při 20 °C. Má-li však tato hodnota zůstat zachována, nesmí článkem nikdy protékat proud. Při jeho používání je proto nutné užívat speciálních měrných metod, zejména kompenzační metody (viz opět [5]). Objev Josephsonova jevu přinesl novou možnost kontroly napětí Westonových normálních článků, popř. kontroly jejich stability (srov. čl. 7.3.5).
K napájení drobných spotřebičů se užívá několik typů primárních článků, které jsou modifikacemi Leclanchéova článku. V původní verzi tohoto článku je záporná elektroda tvořena zinkovou tyčí a kladnou elektrodou je uhlíková tyč obklopená vrstvou burelu (MnO2). Elektrolytem je vodný roztok chloridu amonného (NH4Cl) a chloridu zinečnatého (ZnCI2). Vodivost elektrolytu je zajištěna zápornými ionty Cl- a kladnými ionty Zn2+, NH4+. Vybíjecí proces je charakterizován anodickou reakcí
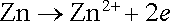 |
a katodickou reakcí
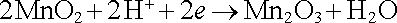 . . |
Při odběru proudu se tedy zinková elektroda rozpouští. V okolí uhlíkové elektrody probíhá komplexní chemická reakce, při níž se burel redukuje vyloučeným vodíkem na (Mn2O3) a vzniklý amoniak spolu se Zn2+ vytváří komplexní kationty [Zn(NH3)2]2+. Pro chemickou reakci celého článku tedy dostáváme rovnici
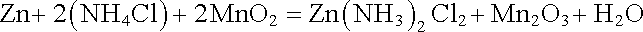 . . |
Elektromotorické napětí Leclanchéova článku činí ~1,5 V.
Po řadu desetiletí je nejhojněji užívanou modifikací Leclanchéova článku tzv. suchý (zinko-uhlíkový) článek. Zápornou elektrodou je zinková nádobka (v původní verzi na vnitřních stěnách pokovená vrstvou rtuti). Kladná elektroda podobného složení jako v článku Leclanchéově je umístěna v ose zinkové nádobky. Elektrolyt je zahuštěn do pastovité konzistence vhodnou látkou - v původní verzi škrobem. Hlavní předností tohoto typu článku a důvodem jeho masového rozšíření je nízká cena. I když se díky technologickému vývoji posledních let jeho užitné vlastnosti značně zlepšily (a k jeho výrobě přestala být užívána rtuť, takže článek je ekologicky neškodný), zůstává jeho hlavní nevýhodou značně vysoký samovybíjecí proud, který omezuje jeho životnost a skladovatelnost. Suchý článek je tudíž nevhodný jako trvalejší zdroj energie. Pro takové použití je mnohem výhodnější tzv. primární alkalický článek. Aktivní materiál jeho elektrod zůstává stejný, díky použití jiného elektrolytu (roztoku hydroxidu draselného KOH o koncentraci 30 až 40%), jsou však elektrodové reakce modifikovány. Anodická a katodická reakce mají postupně tvar
Zn + 2OH ℜ → ZnO + H2O + 2e-,
MnO2 + H2O ℜ → MnOOH + OH-
a chemická reakce v celém článku je popsána rovnicí
Zn + 2MnO2 + H2O = ZnO + 2MnOOH.
Ve srovnání s konvenčním suchým článkem jsou hlavními výhodami alkalických článků nižší časový pokles svorkového napětí při vybíjení a nízký samovybíjecí proud. Tyto články jsou dlouhodobě skladovatelné a mají dlouhou životnost.
b) Sekundární články
Jako historický příklad může sloužit Daniellův článek, který lze regenerovat průchodem proudu opačného směru, v praxi je však dnes nepoužitelný. Ze sekundárních článků je patrně stále nejpoužívanější olověný akumulátor. Základním materiálem obou jeho elektrod je olovo, elektrolytem kyselina sírová v roztoku o koncentraci 25 až 30 %. Účinkem kyseliny se na obou elektrodách vytvoří nerozpustný síran olovnatý. V tomto stavu jsou obě elektrody stejné a akumulátor má nulové elektromotorické napětí. Necháme-li jím však pro-cházet proud z vnějšího zdroje, elektrody se zpolarizují. Na záporné elektrodě se síran olovnatý redukuje na olovo a na kladné elektrodě oxiduje na oxid olovičitý PbO2. V tomto stavu je akumulátor "nabit" a je schopen pracovat jako galva-nický článek. Při odběru proudu se na obou elektrodách vytváří síran olovnatý. Elektromotorické napětí po nabití činí 2,1 V a s vybíjením postupně klesá. Díky nízkému vnitřnímu odporu a schopnosti dodávat značný proud se nejčastěji používá jako startovací baterie v automobilech. Jeho nevýhodou je omezená životnost.
Kromě olověného akumulátoru se dnes užívá řada dalších typů sekundárních (vesměs alkalických) článků a jejich potřeba dramaticky roste s rozvojem mobilní spotřební elektroniky Za klasický je možné považovat Edisonův akumulátor Ni-Fe, jehož elektrody tvoří kovové železo a nikl a jehož elektrolytem je louh draselný (KOH). Elektromotorické napětí se pohybuje kolem hodnoty 1,4 V, použitelné svorkové napětí je přibližně 1,2 V. Ve srovnání s olověným akumulátorem má nevýhodu ve větším vnitřním odporu, větší ceně a nižší účin-nosti, je však trvanlivější. Dnes se používá jen zřídka.
V nedávné době byly hojně používány články nikl-kadmiové (Ni-Cd), u nichž díky pokroku v technologii (především zavedení porézních elektrod) bylo dosaženo řady dobrých užitných vlastností. Elektromotorické i svorkové napětí těchto článků je shodné s typem Ni-Fe, mají však značně vyšší kapacitu a nízké samovolné vybíjení. Jejich podstatnou nevýhodou je však tzv. paměťový efekt; zejména při rychlém nabíjení dochází při zvýšené teplotě k rekrystalizaci aktivního materiálu elektrod a při neúplném dobití klesá nevratně jejich kapacita. Rovněž vzhledem k vysoké toxicitě kadmia se od jejich používání upouští.
Novější alternativou k Ni-Cd článkům je použití kovové slitiny absorbující vodík pro zápornou elektrodu (místo kadmia). Kladnou elektrodu tvoří práškový nikl, elektrolytem je hydroxid draselný. Nabitím přejde nikl v hydroxid niklu, zatímco záporná elektroda přejde v kovový hydrid (metalhydrid). Mluví se proto o článcích nikl-metalhydridových (Ni-MH). Články Ni-MH mají stejné elektromotorické napětí jako dva předchozí typy. K přednostem patří značně vyšší objemová účinnost a absence paměťového jevu, k nevýhodám o hodně vyšší cena a rychlejší samovolné vybíjení.
Novou kapitolou ve vývoji sekundárních článků jsou články na bázi lithia. Lithium tvoří kladnou elektrodu, zatímco pro zápornou elektrodu je známo několik modifikací. Jako příklad zmíníme některé vlastnosti článku lithio-iontového (Li-ion). Průměrná hodnota svorkového napětí je přibližně rovna 3,6 V, což umožňuje sestavit baterii požadovaného napětí z menšího počtu článků. Dosahují vysoké hustoty energie i nižšího samovolného vybíjecího proudu ve srovnání s články Ni-Cd i Ni-MH. Nevýhodou je vysoká cena a předepsaný proces nabíjení. Nevyskytují se proto zpravidla volně na trhu a jsou obvykle (spolu s nabíječkou) součástí dražších zařízení jako jsou mobilní telefony přenosné počítače, videokamery aj.
Konečně, v nedávné době se objevily sekundární alkalické články, které vznikly významným zdokonalením technologie popsaných primárních alkalických článků. Při zachování relativně nízké ceny jsou pro ně deklarovány kladné užitné vlastnosti všech předchozích typů.
c) Palivové články
Palivové články umožňují, aby plynule přiváděné palivo bylo elektrochemicky oxidováno, takže oxidační energie paliva je přímo převáděna na energii elektrickou. Palivo může být ve skupenství plynném (například vodík) i kapalném (například uhlovodíky). V principu může být tento proces přímé pře-měny chemické energie na elektrickou ekonomičtější i ekologičtější ve srovnání s tradičními postupy využívajícími tepelné stroje. Praktické uplatnění je však v počátcích. Princip činnosti palivových článků budeme demonstrovat na příkladu článku kyslíko-vodíkového, který byl používán jako zdroj energie v některých družicích. Jako elektrolyt slouží zpravidla hydroxid draselný (KOH). Vodík jako palivo se oxiduje na záporné elektrodě, na níž probíhá anodická reakce
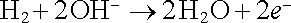 , , |
zatímco na kladné elektrodě probíhá redukční katodická reakce
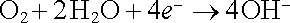 . . |
Elektromotorické napětí článku je ~0,9 V.
Studium elektrodových potenciálů a speciálně polarizačních jevů na elektrodách představuje velmi důležitý obor fyzikální chemie. Na uvedených jevech je založena i důležitá analytická metoda nazývaná polarografie.
Podstata polarografie spočívá ve snímání voltampérové charakteristiky elektrochemické soustavy roztok-elektrody v dynamickém režimu s danou rychlostí změny napětí. Z průběhu této charakteristiky je možné stanovit obsah jednotlivých látek v roztoku na základě parametrů jejich elektrochemické reakce s elektrodou a rychlostí difuze v roztoku.
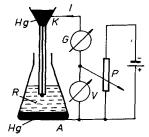
Princip klasického uspořádání pro snímání voltampérové charakteristiky, tzv. polarografické křivky, je uveden na obr. 7.39. Elektrolýza analyzovaného roztoku R probíhá mezi rtuťovými elektrodami. Katoda K, na níž probíhá sledovaná elektrochemická reakce, je přitom tvořena kapkou rtuti odkapávající z tenké kapiláry, čímž je zajištěno její neustálé obnovování, a tedy i vyloučení vlivu její polarizace produkty elektrolýzy. Proud tekoucí roztokem se v klasickém uspořádání měřil (obvykle registračním) galvanometrem G v závislosti na napětí U, jehož rovnoměrný vzrůst předepsanou rychlostí je regulován potenciometrem P.

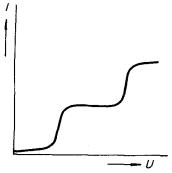
Na obrázku 7.40 je uveden schematický příklad polarografické křivky. Z polohy a výšky jednotlivých stupňů je možné kvantitativně stanovit obsah jednotlivých látek ve zkoumaném roztoku. Vznik těchto stupňů kvalitativně snadno pochopíme. Při malých hodnotách napětí vnějšího zdroje teče obvodem jen nepatrný proud a stav soustavy je blízký rovnovážnému stavu mezi roztokem a elektrodami, který je charakteristický pro galvanický článek bez proudu (viz čl. 7.4.3). Podstatným znakem tohoto stavu je rovněž homogennost koncentrace jednotlivých složek v celém objemu roztoku. Při zvyšování napětí rychlost elektrochemických reakcí na elektrodě vzrůstá, nevzrůstá však rovnoměrně pro všechny druhy látek obsažených v roztoku. Určitým hodnotám napětí odpovídá vždy vzrůst rychlosti reakce určitého typu látky, která se hlavní měrou podílí na vzrůstu proudu v této oblasti charakteristiky. Uvedeným procesem se však koncentrace dané látky v blízkosti elektrody sníží a další zvyšování proudu je omezeno rychlostí difuze příslušných částic v roztoku. V soustavě se tedy ustaví rovnovážný stav daný rovnováhou mezi rychlostí reakce a rychlostí difuze, kterému odpovídá konstantní hodnota proudu. Při dalším zvyšování napětí se pak podobný proces může opakovat pro jinou složku roztoku.