Roztokem rozumíme homogenní soustavu, která se skládá ze dvou nebo z většího počtu chemicky čistých látek. Jedna ze složek roztoku, obvykle ta, která je zastoupena v největším množství, se nazývá rozpouštědlo. V rozpouštědle jsou pak homogenně rozptýleny (dispergovány) molekuly ostatních látek, které označujeme jako látky rozpuštěné.
Roztok podle výše uvedené definice tvoří vždy jedinou fázi, a má tudíž podle Gibbsova fázového pravidla nejméně tři stupně volnosti. Roztoky představující homogenní jednorázovou soustavu nazýváme pravé roztoky.
Roztok může existovat ve skupenství plynném, kapalném a pevném. V prvním případě jím rozumíme směs dvou nebo více plynů, jež spolu chemicky nereagují.
Roztok ve skupenství pevném se nazývá tuhý roztok a rozumíme jím látky pevné fáze obsahující více než jednu složku. V tuhém roztoku tvoří např. jedna krystalická látka s jinou svými atomy společnou krystalickou mřížku. Složení těchto roztoků se může měnit v širokém rozmezí koncentrací. Tato skutečnost, pro tuhé roztoky charakteristická, je odlišuje od krystalů chemických sloučenin (NaCl, Fe3C apod.), jimž náleží zcela určité složení.
Nejběžnějším typem roztoku je roztok, v němž rozpouštědlem je kapalina. Složení roztoku je charakterizováno jejich koncentrací. Obvykle používáme některou z těchto definic koncentrace:
Molární koncentraci (molaritu) roztoku cmol vyjadřujeme podílem látkového množství n rozpuštěné látky a odpovídajícího objemu V roztoku, tedy
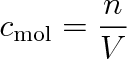 |
(9.22) |
Od molarity je třeba rozlišovat molalitu rozpuštěné látky (i-té složky roztoku), jíž rozumíme podíl látkového množství n této složky a hmotnosti m rozpouštědla:
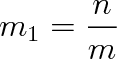 |
(9.23) |
Časté je vyjadřování složení roztoku molárním zlomkem x. Jsou-li látková množství složek roztoku včetně rozpouštědla A, B, C, ... dána symboly nA, nB, nc, . . . , je molární zlomek složky A definován vztahem
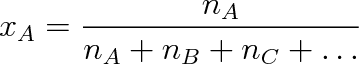 |
(9.24) |
Je zřejmé, že pro N složek roztoku včetně rozpouštědla platí
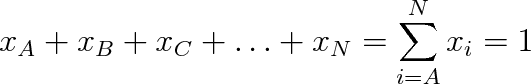 |
Kromě molární koncentace se velmi často používá koncentrace objemové a koncentrace hmotnostní. Při objemové koncentraci se udává poměr hmotnosti rozpuštěné látky a objemu roztoku. Koncentrace hmotnostní se stanoví podílem hmotnosti rozpuštěné látky a zvolené hmotnosti roztoku (nejčastěji se volí hmotnost 100 g).
Proces rozpouštění je doprovázen uvolňováním nebo pohlcováním tepla. Teplo, které se uvolní nebo pohltí při rozpouštění látky o jednotkovém látkovém množství v rozpouštědle o velké hmotnosti, se nazývá molární rozpouštěcí teplo. Definice molárního rozpouštěcího tepla pochopitelně předpokládá, že rozpouštěná látka nereaguje chemicky s rozpouštědlem. Ukazuje se, že při rozpouštění kapalin nebo plynů v kapalných rozpouštědlech se zpravidla teplo uvolňuje. Uvolněné teplo pokládáme za kladné. Naopak rozpouštění pevných látek v kapalinách je obvykle spojeno s pohlcováním tepla. Pohlcené teplo označujeme jako záporné.
V daném rozpouštědle o stanovené hmotnosti lze za daných podmínek (teploty a tlaku) rozpouštět zvolenou látku jen do určitého množství. Roztok, který obsahuje maximální množství látky, jež lze v něm ještě rozpustit, se nazývá nasycený roztok. Přidáme-li k nasycenému roztoku jakékoli množství této látky, jež je v něm rozpuštěna, koncentrace roztoku nevzroste a přidaná látka zůstane nerozpuštěná.
Koncentrace příslušející nasycenému roztoku se nazývá rozpustnost dané látky. Udává se nejčastěji molaritou nebo objemovou čí hmotnostní koncentrací.
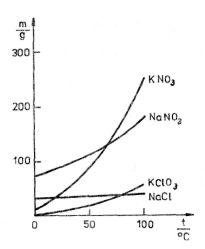 Obr. 9-16
Obr. 9-16
se rozpustí 360 g, dusičnanu stříbrného 220 g a třtinového cukru 204 g vesměs ve 100 g vody. Naopak nepatrně je ve vodě rozpustný síran barnatý, kterého se ve 100 g vody rozpouští jen 0,000 23 g, nebo chlorid stříbrný, jehož se ve 100 g vody rozpouští 0,000 14 g, aj.
Rozpustnost závisí obvykle dosti silně na teplotě a v menší míře na tlaku. Jde-li o vodní roztoky pevných látek (nejčastěji solí), rozpustnost s rostoucí teplotou a tlakem zpravidla vzrůstá. Charakter závislosti rozpustnosti na teplotě ukazuje obr. 9-16, v němž jsou zakresleny křivky rozpustnosti čtyř bezvodných solí. Křivky udávají pro každou teplotu mezi 0 °C a 100 °C maximální hmotnost soli v gramech, jež se rozpouští ve 100 g vody. Z obrázku je vidět, že u kamenné soli (NaCl) roste rozpustnost s teplotou jen nepatrně (v intervalu mezi 0 °C a 100 °C z hodnoty 35,7 g na 39,8 g), kdežto u většiny ostatních rozpuštěných látek je tato závislost značná.
Zvýšení nebo pokles rozpustnosti v závislosti na teplotě úzce souvisí se znaménkem rozpouštěcího tepla. Je-li rozpouštění látky doprovázeno pohlcováním tepla, tj. je-li rozpouštěcí teplo záporné, rozpustnost takové látky se s rostoucí teplotou zvyšuje. Jestliže se naopak při rozpouštění teplo uvolňuje (rozpouštěci teplo je kladné), zvýšení teploty způsobí zmenšení rozpustnosti.
Při rozpouštění kapaliny v jiné kapalině mohou nastat tři případy:
a) Kapaliny se navzájem rozpouštějí v libovolných poměrech, takže vzniká jediná fáze. Typickým příkladem je roztok vody a ethylalkoholu, jež se spolu neomezeně mísí.
b) Vzájemná rozpustnost kapalin je omezená, takže se rozpouštějí jen v určitých rozmezích koncentrací. Smísíme-li např. vodu s éterem, vzniknou obecně dva homogenní roztoky, z nichž jeden má za pokojové teploty složení
6,48 % éteru a 93,52 % vody a druhý
1,22 % vody a 98,78 % éteru.
Prvý představuje nasycený roztok éteru ve vodě, druhý nasycený roztok vody v éteru. S rostoucí teplotou klesá rozpustnost éteru ve vodě, zato roste rozpustnost vody v éteru.
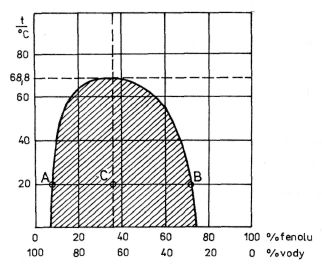 Obr. 9-17
Obr. 9-17
Někdy se stává, že vzájemné rozpustnosti obou kapalin s teplotou rostou nebo naopak klesají. Prvý příklad vede k existenci tzv. horní kritické teploty, druhý k existenci dolní kritické teploty. Tyto kritické teploty se vyznačují tím, že nad horní kritickou teplotou, popřípadě pod dolní kritickou teplotou, jsou obě kapaliny v libovolných poměrech. Příkladem kapalin s existencí horní kritické teploty je voda a fenol (C6H5OH). Při teplotě 20 °C se rozpouští ve vodě 8,4 % fenolu a ve fenolu 27,8 % vody. Se vzrůstající teplotou se rozpustnost fenolu i vody zvětšuje, až po dosažení horní kritické teploty 68,8 °C se začnou obě kapaliny mísit ve zcela libovolných poměrech. Dobře je toto chování patrné z obr. 9-17, v němž je znázorněna mezní křivka rozpustnosti soustavy voda a fenol, udávající meze rozpustnosti obou kapalin vzhledem k teplotě. Tak např. bod A udává mez rozpustnosti fenolu ve vodě, bod B mez rozpustnosti vody ve fenolu při 20 °C. Body grafu ležící mimo vyšrafovanou oblast ohraničenou mezní křivkou rozpustnosti představují jedinou homogenní fázi, která je vzájemným roztokem vody a fenolu, lhostejno zda roztoku fenolu ve vodě či vody ve
fenolu. Naproti tomu body uvnitř vyšrafované plochy představují dvě různé fáze, z nichž jednou je nasycený roztok fenolu ve vodě (při 20 °C bod A) a druhou nasycený roztok vody ve fenolu (bod B). Poměr hmotností obou těchto fází je v obráceném poměru délek úseček AC a BC, odpovídá-li bod C podle obr. 9-17 koncentraci směsi vody a fenolu při 20 °C. Je dobré si všimnout analogie mezní křivky rozpustnosti s mezní křivkou zavedenou v souvislosti s van der Waalsovými izotermami. Body vně této křivky rovněž náleží jediné fázi (kapalině nebo plynu) a body uvnitř dvoufázové soustavě (kapalině a její syté páře), viz kap. 7.
Příkladem směsi kapalin s dolní kritickou teplotou je směs vody a triethylaminu (C2H5)3N. Za teplot vyšších, než je dolní kritická teplota (18,6 °C), mísí se triethylamin s vodou nebo naopak jen v omezené míře, kdežto pod touto kritickou teplotou se obě kapaliny navzájem rozpouštějí v libovolných poměrech.
U některých směsí kapalin existují obě kritické teploty. Takovými kapalinami je např. voda a nikotin C10H14N2, které se pod dolní a nad horní kritickou teplotou mísí v libovolných poměrech, zatímco mezi těmito teplotami je jejich vzájemná rozpustnost omezená.
c) Kapaliny se navzájem vůbec nerozpouštějí. Takovými kapalinami jsou např. sirouhlík CS2 a voda.
Kromě pevných látek a kapalin rozpouštějí se v kapalinách i plyny.
Závislost rozpustnosti plynů na tlaku vyjadřuje Henryův zákon (1803), podle něhož hmotnost plynu, který se při konstantní teplotě rozpouští v kapalině jednotkového objemu, je úměrná plynu nad kapalinou. Z Boylova-Mariottova zákona vyplývá, že tlak p plynu je přímo úměrný jeho hustotě
 , takže platí
, takže platí
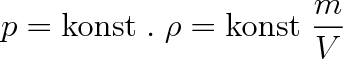 |
(9.26) |
kde m je hmotnost rozpuštěného plynu a V jeho objem. Zvýší-li se tedy tlak z hodnoty p na 2p a zvětší-li se v důsledku Henryova zákona hmotnost plynu z hodnoty m na 2m, zůstane, jak plyne z rov. (9.26), objem V rozpuštěného plynu konstantní. To však znamená, že kapalina daného objemu absorbuje při téže teplotě za různých tlaků vždy plyn stejného objemu. Poměr objemu V rozpuštěného plynu k objemu V0 kapaliny
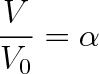 |
(9.27) |
je za dané teploty stálý a vyjadřuje jinou formou Henryův zákon. Součinitel
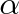 , nazývající se Ostwaldův součinitel rozpustnosti nebo krátce rozpustnost, stanoví objem plynu rozpuštěného v objemové jednotce kapaliny při dané teplotě. Tento součinitel nezávisí na tlaku plynu a s rostoucí teplotou u většiny plynů klesá. Pro
, nazývající se Ostwaldův součinitel rozpustnosti nebo krátce rozpustnost, stanoví objem plynu rozpuštěného v objemové jednotce kapaliny při dané teplotě. Tento součinitel nezávisí na tlaku plynu a s rostoucí teplotou u většiny plynů klesá. Pro
Tabulka 9-3 Součinitel rozpustnosti plynů ve vodě
|
Plyn |
Součinitel rozpustnosti a ve vodě při teplotě (uvedeno ve °C) |
||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
|
čpavek NH3 |
1 299 |
910 |
' 709 |
593 |
|||
|
chlorovodík HCI |
507 |
474 |
442 |
411 |
386 |
362 |
339 |
|
oxid siřičitý SO2 |
79,8 |
56,6 |
39,4 |
27,2 |
18,8 |
||
|
sirovodík H2S |
4,6 |
3,4 |
2,6 |
2,0 |
1,6 |
1,4 |
1,2 |
ilustraci je v tabulce 9-3 uveden součinitel rozpustnosti a některých plynů při různých teplotách, které se ve vodě silně rozpouštějí.
 Obr. 9-18
Obr. 9-18
Stýká-li se s kapalinou směs plynuje hmotnost každého rozpouštěného plynu ze směsi tak velká, jakoby byl plyn nad kapalinou sám. To však znamená, že procentové složení směsi vzhledem k různé rozpustnosti jednotlivých plynů obecně nesouhlasí s jejich procentovým složením po rozpuštění směsi v kapalině. Tak např. ve vzduchuje podle objemu přibližně 21 % kyslíku a 79 % dusíku. Je-li vzduch rozpuštěn ve vodě, absorbuje se při teplotě 20 °C a za normálního tlaku (srovn. s obr. 9-18) v každém kubickém centimetru vody 6,51 . 10-3 cm3 kyslíku a 12,64 . 10-3 cm3 dusíku, což činí 34 % kyslíku a 66 % dusíku. Z toho vyplývá, že vzduch rozpuštěný ve vodě je bohatší na kyslík, neboť ho obsahuje 34 %, kdežto normální atmosférický vzduch pouhých 21 %.