Na rozdíl od roztoků, o nichž jsme pojednali v přechozím článku a které nazýváme pravými roztoky, existující roztoky nepravé charakterizované tím, že látky vstupující do roztoku nejsou v něm molekulárně dispergovány. Nepravý roztok vzniká tehdy, Jsou-li v kapalném rozpouštědle jemně rozptýleny drobné částice buď pevné látky, nebo kapaliny, jež se v daném rozpouštědle neroz-pouští. Jde-li o rozptýlenou látku pevnou, např. grafitový prach ve vodě, mluvíme o suspenzi, v případě rozptýlené kapaliny, vytvořené např. drobnými kapičkami oleje ve vodě, nazýváme nepravý roztok emulzí. Částice tvořící suspenzi nebo emulzi mívají rozměry ležící v intervalu 10-4 mm až 10-2 mm a jsou ve většině případů zjistitelné optickým mikroskopem. V kapalném rozpouštědle konají tyto částice nepravidelný pohyb, který je za daných podmínek tím živější, čím jsou menších rozměrů (viz Brownův pohyb, čl. 5.11). U suspenzí i emulzí dochází po delší době k rozdělení v jejich složky. Odstřeďováním lze tento proces urychlit.
Kromě suspenzí a emulzí existují také kapalné roztoky tvořené částicemi, jejichž rozměry jsou menší než 10-4 mm, nikoli však srovnatelné s rozměrem jednotlivých molekul (~ 10-7 mm). Takové roztoky nazýváme koloidní. Koloidní roztoky jsou dvojího druhu. Buď jsou tvořeny mikrokrystalky kovů, jež jsou v kapalném prostředí jemně rozptýleny a dávají koloidnímu roztoku charakteristické zabarvení, nebo „rozpuštěnými" částicemi jsou shluky organických molekul (makromolekul). Koloidní roztoky tvoří přechod mezi pravými roztoky a roztoky, jakými jsou suspenze a emulze. To, že koloidní roztok se liší od suspenze velikostí částic, projevuje se tím, že v koloidním roztoku zpravidla nelze filtrací oddělit „rozpuštěnou" látku (koloid) od vlastního rozpouštědla, i když použijeme jemnějších filtrů, než je obyčejný filtrační papír.
9.11 Osmotický tlak
Difúzi kapalin přes pórovité stěny nazýváme osmózou. Lze vytvořit polopropustné stěny, jež mají tu vlastnost, že propouštějí pouze molekuly rozpouštědla a nikoli molekuly rozpuštěné látky.
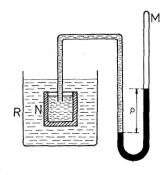 Obr. 9-19
Obr. 9-19
Ponoříme-li do nádoby R, obsahující vodu, menší nádobu N, jejíž stěny jsou vyrobeny z vhodného polorozpustného materiálu a která je naplněna vodným roztokem některé soli, začne tlak v manometru M připojeném k nádobě N rychle stoupat (obr. 9-19). Tento růst tlaku je vyvolán pronikáním molekul vody polopropustnými stěnami do nádoby N. S rostoucím tlakem se počet molekul pronikající vody zmenšuje, a při dosažení jistého tlaku p se vytvoří rovnovážný stav. Tlak p roztoku, který odečteme na manometru, a který odpovídá rovnovážnému stavu, se nazývá osmotický tlak.
Osmotický tlak silně zředěných roztoků se řídí rovnicí podobnou stavové rovnici ideálního plynu, kterou lze psát také ve tvaru
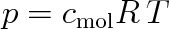 |
(9.29) |
značí-li cmo! molární koncentraci rozpuštěné látky v roztoku, pro kterou platí vztah (9.22).
Skutečnost, že osmotický tlak lze u silně zředěných látek roztoků vyjádřit stavovou rovnicí ideálního plynu, je ve shodě s rov. (9.28) v předchozím článku a s tvrzením v něm obsaženým. Rov. (9.29) vyjadřující zákon varit Hoffův říká, že osmotický tlak roztoku je právě tak velký, jako kdyby rozpuštěná látka byla v plynném stavu a přitom měla objem a teplotu roztoku. Z van't Hoffova zákona vyplývá, že osmotický tlak roztoku je při dané koncentraci přímo úměrný koncentaci roztoku. Roztoky, které mají při téže teplotě a objemu stejné látkové množství rozpuštěné látky, mají stejný osmotický tlak a nazývají se izotonické roztoky.
Van't Hoffův zákon ve tvaru, jak byl výše formulován, platí pouze pro roztoky neelektrolytické. V elektrolytických roztocích (elektrolytech) je třeba koncentraci Cmol v rov. (9-29) přiřadit jinou hodnotu. Příčinou toho je, že v elektrolytech jsou molekuly zčásti nebo plně disociovány na ionty, které se z hlediska uvažovaného děje chovají jako samostatné molekuly. Disociací roste molekulová koncentrace roztoku a zároveň i jeho osmotický tlak. Mírou disociace elektrolytu je disociační stupeň S definovaný poměrem
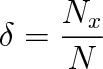 |
(9.30) |
v němž Nx značí počet molekul disociovaných na ionty z celkového počtu N molekul roztoku. Štěpí-li se každá z Nx molekul na j iontů, vytvoří se v objemové jednotce celkem N' částic (iontů a molekul). Pro tento počet zřejmě platí
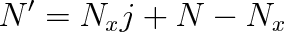 |
Dosadíme-li do tohoto vztahu za Nx podle rov. (9.30), dostaneme po úpravě
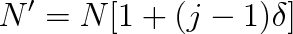 |
(9.31) |
Označme p osmotický tlak, který by byl v roztoku, kdyby žádná z N molekul nebyla disociována, a p osmotický tlak odpovídající N' částic v roztoku. Poněvadž tlak roste úměrně s počtem částic, bude pro poměr tlaků p'/p platit
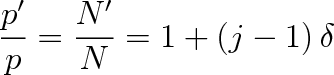 |
a odtud pro osmotický tlak p' elektrolytického roztoku dostáváme vztah
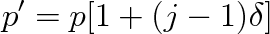 |
(9.32) |