Kritický bod může sloužit jako referenční stav pro porovnání vlastností různých plynů. Zavedeme-li do stavové rovnice redukované hodnoty stavových veličin, které jsou definovány jako poměr hodnoty stavové veličiny k hodnotě kritické, dostaneme redukovaný tvar stavové rovnice. Označíme
redukovaný tlak
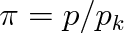 ,
,
redukovaný objem
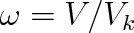 ,
,
redukovanou teplotu
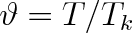 a dosadíme do rovnice (7.2a). S přihlédnutím ke vztahům (7.10) získáme redukovaný tvar van der Waalsovy rovnice
a dosadíme do rovnice (7.2a). S přihlédnutím ke vztahům (7.10) získáme redukovaný tvar van der Waalsovy rovnice
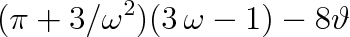 |
(7.13) |
V této rovnici nevystupují explicitně žádné parametry, které by charakterizovaly individuální vlastnosti plynu. Redukovaná van der Waalsova rovnice by měla proto mít univerzální platnost, obdobně jako má rovnice (7.1) pro ideální plyn. V daném konkrétním tvaru však rovnice (7.13) v sobě zahrnuje model, který vedl k rovnici (7.2a). Ten je splněn jen přibližně, a proto ani rovnice (7.13) nemůže plně vystihnout skutečnost.
Předchozí úprava stavové rovnice zřejmě vedla van der Waalse k vyslovení teorému korespondujích stavů, podle kterého existuje univerzální funkce redukovaných stavových veličin
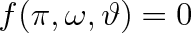 |
(7.14) |
popisující přesně chování soustavy. Teorém korespondujících stavů se používá nejen pro vystižení stavového chování plynů a případně kapalin, ale též v jiných oblastech fyziky, například v magnetismu. Pomocí tohoto teorému lze odhadnout vlastnosti látky jen z malého počtu obvykle snadno dostupných údajů.
Explicitní tvar funkce (7.14) není znám. Existuje jen řada aproximativních výrazů, z nichž jeden představuje rovnice (7.13). Byla však sestavena celá řada tabulek a diagramů, které poměrně dobře vystihují stavové chování plynů.
Nejjednodušší tabulky a grafy jsou dvouparametrové. Jejich autoři vycházejí z předpokladu, že existuje univerzální funkce (7.14), z níž by bylo možno vypočítat jednu z redukovaných stavových proměnných jako funkci zbývajících dvou. Jako nezávisle proměnné se zpravidla berou redukovaný tlak a redukovaná teplota. Pro kompresibilitní faktor pak můžeme psát
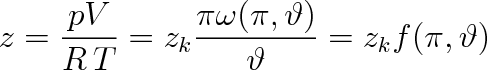 |
(7.15) |
Jeden z takových diagramů je zakreslen na obrázku 7-5 s izotermami pro několik redukovaných teplot
 . Přesnost odhadu stavového chování z takovýchto diagramů nebo grafů se pohybuje kolem 3 %, s výjimkou okolí kritického bodu.
. Přesnost odhadu stavového chování z takovýchto diagramů nebo grafů se pohybuje kolem 3 %, s výjimkou okolí kritického bodu.
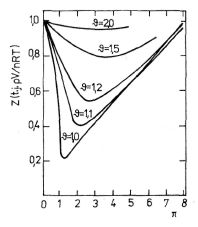 Obr. 7-5
Obr. 7-5
Van der Waalsova formulace teorému korespondujících stavů byla v podstatě heuristická a nemůžeme z ní získat informace o podmínkách platnosti teorému. Zpracování velkého počtu experimentálních dat ukázalo, že teorém korespondujících stavů velmi dobře platí pro molekuly s jednoduchou strukturou, jako je dusík, oxid uhličitý, nízkomolekulární uhlovodíky a některé vzácné plyny. Celkem překvapivě velké odchylky byly zjištěny pro vodík, helium a neon a dále pro polární molekuly nebo látky se značně nesymetrickým rozdělením hmotnosti v molekule. Stanovit meze platnosti teorému korespondujících stavů lze jen tehdy, odvodí-li se na základě strukturních představ.
V roce 1939 formuloval Pitzer podmínky, za kterých lze teorém korespondujících stavů odvodit metodami statistické fyziky. Jsou to předpoklady o vlastnostech a silovém působení molekul:
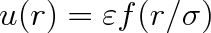 |
(7.16) |
kde
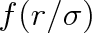 je univerzální funkce vzdálenosti dvou molekul a
je univerzální funkce vzdálenosti dvou molekul a
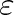 je parametr charakterizující energii u(r) tohoto působení. Parametr
je parametr charakterizující energii u(r) tohoto působení. Parametr
 charakterizuje průměrnou vzdálenost atomů v molekule. Již v článku 5.8 jsme viděli, že pro vysvětlení teplotní závislosti molární tepelné kapacity lehkých molekul (vodík) je nutný kvantově mechanický přístup při nízkých teplotách. Lze proto očekávat, a výsledky to ukazují, že prvý předpoklad nemusí být splněn u látek, které jsou v plynném stavu za nízkých teplot. U molekul s dlouhými řetězci nebude splněn druhý předpoklad, dochází-li k vzájemnému ovlivňování rotačních a vibračních stavů. Třetí předpoklad není splněn například u polárních molekul. Poslední předpoklad vyžaduje, aby energie vyplývající z mezimolekulárního působení závisela pouze na vzdálenosti molekul a nikoliv na jejich orientaci. Tento předpoklad nebude splněn nejen u polárních molekul, ale též u molekul se značně nesymetrickým rozložením hmotnosti.
charakterizuje průměrnou vzdálenost atomů v molekule. Již v článku 5.8 jsme viděli, že pro vysvětlení teplotní závislosti molární tepelné kapacity lehkých molekul (vodík) je nutný kvantově mechanický přístup při nízkých teplotách. Lze proto očekávat, a výsledky to ukazují, že prvý předpoklad nemusí být splněn u látek, které jsou v plynném stavu za nízkých teplot. U molekul s dlouhými řetězci nebude splněn druhý předpoklad, dochází-li k vzájemnému ovlivňování rotačních a vibračních stavů. Třetí předpoklad není splněn například u polárních molekul. Poslední předpoklad vyžaduje, aby energie vyplývající z mezimolekulárního působení závisela pouze na vzdálenosti molekul a nikoliv na jejich orientaci. Tento předpoklad nebude splněn nejen u polárních molekul, ale též u molekul se značně nesymetrickým rozložením hmotnosti.
Pro plyny, které splňují výše uvedené předpoklady, platí dvouparametrový teorém korespondujících stavů a pro kompresibilitní faktor je možno psát vztah
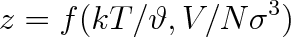 |
(7.17) |
Veličiny
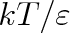 a
a
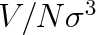 mají obdobný význam jako redukovaná teplota a objem. Jsou tedy rovnice (7.15) a (7.17) ekvivalentní. Parametry
mají obdobný význam jako redukovaná teplota a objem. Jsou tedy rovnice (7.15) a (7.17) ekvivalentní. Parametry
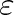 a
a
 se stanovují z hodnot stavových veličin v kritickém bodě. Pro plyny, které nejlépe splňují teorém korespondujících stavů, platí
se stanovují z hodnot stavových veličin v kritickém bodě. Pro plyny, které nejlépe splňují teorém korespondujících stavů, platí
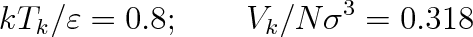 |
(7.18) |
Ilustrujme si nyní užitečnost teorému korespondujících stavů. Předpokládejme, že máme v široké oblasti teplot a objemů proměřeno stavové chování referenční látky, jež splňuje předpoklady 1 až 4. Jsou-li pro ni zároveň známy hodnoty parametrů
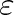 ,
,
 , můžeme naměřené závislosti vyjádřit v proměnných vystupujících ve vztahu (7.17). Pro každou další látku, která též splňuje uvedené předpoklady, popíšeme stavové chování z dat získaných pro referenční látku, zjistíme-li hodnoty parametrů
, můžeme naměřené závislosti vyjádřit v proměnných vystupujících ve vztahu (7.17). Pro každou další látku, která též splňuje uvedené předpoklady, popíšeme stavové chování z dat získaných pro referenční látku, zjistíme-li hodnoty parametrů
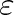 a
a
 .
.
Rozšíření teorému korespondujících stavů na látky nesplňující Pitzerovy předpoklady je problematické. Byla navržena řada zobecnění, v nichž kromě podobnosti objemové
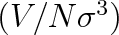 a podobnosti v teplotním chování (člen
a podobnosti v teplotním chování (člen
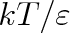 ), je zahrnuta i podobnost tvarová, v rozdělení nábojů, v polarizova-telnosti, v kvantovém chování atd. Teoretické výpočty jsou velmi obtížné, experimentálně lze vliv jednotlivých parametrů sledovat izolovaně jen ve výjimečných případech. Ani pomocí velmi přesných měření nelze s rozumnou přesností vyhodnotit současně větší počet parametrů.
), je zahrnuta i podobnost tvarová, v rozdělení nábojů, v polarizova-telnosti, v kvantovém chování atd. Teoretické výpočty jsou velmi obtížné, experimentálně lze vliv jednotlivých parametrů sledovat izolovaně jen ve výjimečných případech. Ani pomocí velmi přesných měření nelze s rozumnou přesností vyhodnotit současně větší počet parametrů.