Na obr. 7-3 jsou zakresleny izotermy oxidu uhličitého naměřené MlCHELSEM a jeho spolupracovníky v roce 1937. Čísla u křivek znamenají teplotu ve °C. Na vodorovné ose je vynesen molární objem.
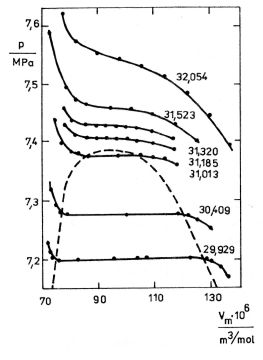 Obr. 7-3
Obr. 7-3
Izotermy se v této oblasti hodnot stavových veličin podstatně liší od hyperbol, které by odpovídaly průběhu podle stavové rovnice ideálního plynu. V oblasti, která je vymezená čárkovanou křivkou, tvoří izotermy úsečky rovnoběžné s vodorovnou osou. Je to oblast, v níž plyn při stlačování postupně kapalní. Tak, jak se zmenšuje objem soustavy, vzrůstá podíl kapalné fáze až na levém okraji vodorovného úseku přejde veškerá látka do kapalného stavu a při dalším stlačování začne tlak prudce stoupat.
S rostoucí teplotou plynu se délka vodorovného úseku izoterm zkracuje, až na izotermě, kterou nazveme kritickou, nalezneme pouze inflexní bod. Tento bod nazýváme kritický bod, v něm musí být nejméně prvé dvě derivace tlaku podle objemu (při konstantní teplotě) nulové. Nejnižší nenulová derivace je záporná, tlak v soustavě musí růst se zmenšujícím se objemem. Proto matematicky zapíšeme podmínku pro kritický bod výrazy
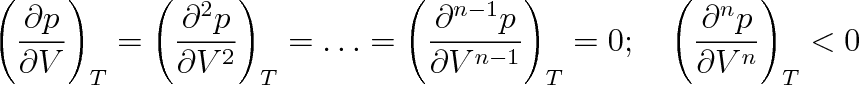 |
(7.5) |
Stavové veličiny v kritickém bodě nazýváme kritický tlak pk, kritický objem Vk a kritická teplota Tk. Při kritické teplotě přejde plyn skokem do kapalného stavu, dosáhne-li objem nebo tlak kritické hodnoty Vk nebo pk. Nad kritickou teplotou nedosáhneme jakýmkoliv stlačením přechodu z plynného do kapalného stavu. Existuje zde kontinuita stavů a nemá smysl rozlišovat plyn a páru. Mluví se o fluidním stavu.
Tabulka 7-1 Kritické hodnoty stavových veličin
|
Chem. značka |
Kritický |
Kritická |
Kritická |
|
|
Název |
tlak pk(MPa) |
teplota Tk(K) |
hustota
|
|
|
Ar |
argon |
4,86 |
150.71 |
531 |
|
Cl2 |
chlor |
7,71 |
417,15 |
573 |
|
He |
helium |
0,229 |
5,2 |
63 |
|
N2 |
dusík |
3,40 |
126,25 |
319 |
|
Ne |
neon |
2,72 |
44,43 |
484 |
|
O2 |
kyslík |
5,08 |
154,78 |
410 |
|
CO |
oxid uhelnatý |
3,50 |
132,91 |
301 |
|
CO2 |
oxid uhličitý |
7,38 |
304,19 |
468 |
|
H2O |
voda |
22,13 |
647,3 |
328 |
|
CH4 |
metan |
4,64 |
190,7 |
162 |
Kritické hodnoty stavových veličin uvádíme v tabulce 7-1. Místo kritického objemu Vk je uvedena kritická hodnota hustoty
 . Kritický objem Vk bychom stanovili z molární hmotnosti Mm a kritické hustoty,
. Kritický objem Vk bychom stanovili z molární hmotnosti Mm a kritické hustoty,
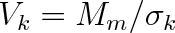 .
.
Položíme si nyní otázku, zda lze popsat chování plynu v okolí kritického bodu pomocí stavové rovnice. Podmínkou pro existenci kritického bodu (viz (7.5)), existence nulové hodnoty alespoň prvých dvou derivací tlaku podle objemu, lze splnit, má-li stavová rovnice nejméně dva nastavitelné parametry. Nejjednodušší dvouparametrová stavová rovnice je van der Waalsova rovnice (7.2a). Zkusíme, jak přesně pomocí ní lze popsat chování plynu o jednotkovém látkovém množství v okolí kritického bodu.
Z rovnice (7.2a) plyne, že kritický tlak pk lze vyjádřit pomocí kritické teploty Tk a objemu Vk vztahem
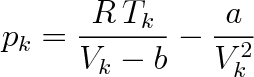 |
(7.6a) |
V kritickém bodě musí být prvé dvě derivace tlaku podle objemu rovny nule (viz (7.5)). Z této podmínky získáme vztahy
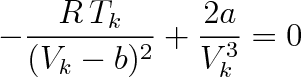 |
(7.6b) |
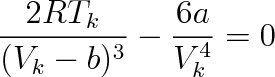 |
(7.6c) |
Získali jsme soustavu tří lineárně nezávislých rovnic, ze kterých však máme určit pouze dva volitelné parametry. To svědčí o tom, že van der Waalsova rovnice nepopisuje chování reálného plynu přesně, a proto nemůžeme jednoznačně určit hodnoty parametrů a, b.
Nejsnadněji se parametry a, b vyjádří z rovnic (7.6b) a (7.6c). Vydělíme-li tyto dvě rovnice mezi sebou, získáme vztah
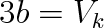 |
(7.7a) |
Po dosazení za b do (7.6b) dostaneme pro zbývající parametr výraz
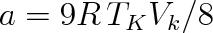 |
(7.7b) |
Dosud jsme nepoužili rovnici (7.6a). Dosadíme-li do ní ze vztahů (7.7a, b), dostaneme relaci mezi stavovými veličinami v kritickém bodě. Platí
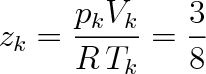 |
(7.8) |
Při popisu stavového chování plynu se velmi často využívá veličiny z nazývané kompresibilitní faktor a definované vztahem
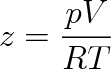 |
(7.9) |
Výraz (7.8) tedy určuje hodnotu kompresibilitního faktoru zk v kritickém bodě. Podle van der Waalsovy rovnice by měl být tento faktor pro všechny plyny stejný a roven hodnotě 0,375.
Tabulka 7-2 Van der Waalsovy koeficienty a hodnoty kompresibilitního faktoru zk
|
Van der Waalsovy koeficienty |
Kompresibilitní |
||
|
Látka |
a (J . m3 . mol-2) b . 106 (m3 . mol-1) |
faktor |
|
|
Ar |
0,134 |
32,2 |
0,308 |
|
Cl2 |
0,650 |
56,2 |
0,229 |
|
He |
0,003 4 |
23,6 |
0,307 |
|
N2 |
0,135 |
38,6 |
0,291 |
|
Ne |
0,209 |
17,0 |
0,255 |
|
O2 |
0,136 |
31,7 |
0,294 |
|
CO |
0,145 |
39,5 |
0,245 |
|
CO2 |
0,365 7 |
42,84 |
0,275 |
|
H2O |
0,552 |
30,4 |
0,226 |
|
CH4 |
0,229 |
42,75 |
0,286 |
Snadno se přesvědčíme, že hodnota zk = 0,375 nemá univerzální platnost. Dosaďme do vztahu (7.8) hodnoty stavových veličin v kritickém bodě například pro oxid uhličitý. Tyto hodnoty jsou uvedeny v tabulce 7-1. Pro kompresibilitní faktor v kritickém bodě dostaneme zk = 0,275, tj. o 30 % nižší. Obdobně bychom získali menší hodnoty i pro jiné plyny, viz tab. 7-2. Nesplnění vztahu (7.8) je pak příčinou, že získáme různé hodnoty pro koeficienty a, b van der Waalsovy rovnice, podle toho, ze kterých stavových veličin je určujeme.
Nejčastěji se uvádí vyjádření parametrů a, b pomocí hodnot teploty Tk a tlaku pk v kritickém bodě. Obě tyto veličiny jsou přímo měřitelné. Příslušné výrazy dostaneme, dosadíme-li do vztahů (7.7) za Vk hodnotu vyjádřenou podle (7.8). Platí
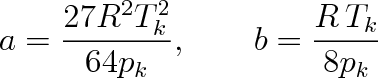 |
(7.10) |
Podle těchto vztahů nalezneme stanovené hodnoty zpravidla ve fyzikálních tabulkách jako van der Waalsovy koeficienty. Poznamenejme, že relace (7.7) pak platí jen velmi přibližně. Například pro oxid uhličitý je Vk = 9,4 m3 . mol-1, 3b = 128 m3. mol-1. Pro vybrané plyny uvádime hodnoty van der Waalsových konstant opět v tabulce 7-2.
Obdobným postupem je možno vyjádřit parametry a, b i pro jiné dvoupara-metrové stavové rovnice. Pro Berthelotovu i Redlichovu-Kwongovu rovnici bychom pro b získali stejný výraz jako v (7.10). Aby se dosáhlo lepší shody s experimentálními daty, volí se ryze empiricky u Berthelotovy rovnice jiný číselný faktor ve výrazu pro b a udávají se vztahy
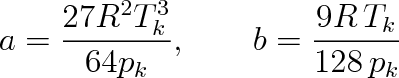 |
(7.11) |
V Redlichově-Kwongově rovnici se empiricky nastavují oba číselné faktory
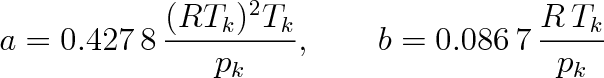 |
(7.12) |
Vraťme se k otázce souhlasu van der Waalsových a skutečných izoterm. V obrázku 7-4 jsou překresleny tři izotermy z obrázku 7-3: nadkritická, měřená při teplotě 32,054 °C, podkritická, změřená při teplotě 29,929 °C a izoterma, kterou můžeme považovat za kritickou (tk = 31,013 °C). Čárkovaně je zakreslena soustava tří van der Waalsových izoterm pro stejné teploty. Průběh izoterm byl
 Obr. 7-4
Obr. 7-4
počítán s van der Waalsovými konstantami pro oxid uhličitý, uvedenými v tabulce 7-2.