Uvažujeme trubici o obsahu průřezu S, ve kterém máme přepážkou odděleny dva druhy plynů. Předpokládejme, že tlak i teplota v obou částech trubice jsou stejné, oba plyny jsou v tepelné rovnováze. Po odstranění přepážky se v důsledku tepelného pohybu molekuly začnou oba plyny mísit, dojde k difúznímu toku.
 Obr. 6-3
Obr. 6-3
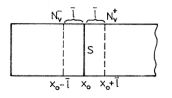
Sledujme difúzní tok trubicí na obr. 6-3 v čase t po odstranění přepážky. Rozdíly v hustotě molekul jsou pouze ve směru osy trubice.
x-ová souřadnice přepážky je x0. Průřezem trubice v místě, kde byla přepážka, mohou projít za čas dt zleva doprava jen ty molekuly, jejichž x-ová složka rychlosti je kladná a nejsou v daném okamžiku vzdáleny od tohoto průřezu o více než
 . Pro střední hodnotu kladných x-ových složek rychlosti
. Pro střední hodnotu kladných x-ových složek rychlosti
 platí
, že
platí
, že
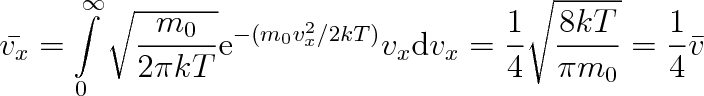 |
Počet molekul prošlých za čas dt průřezem obsahu S zleva doprava bude roven
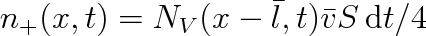 |
(6.8) |
Obdobně pro počet molekul procházejících zprava doleva, to jest ve směru záporné osy x, bude platit
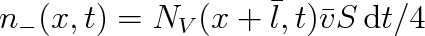 |
(6.9) |
Tyto dva toky molekul míří proti sobě, a proto se odečítají, takže hustota difúzního toku bude rovna
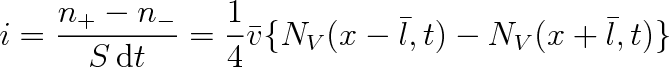 |
Rozdíl hustot můžeme vyjádřit pomocí gradientu hustoty
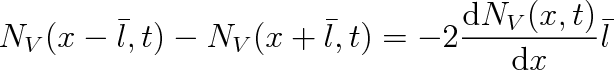 |
takže bude platit
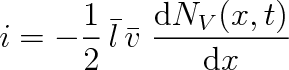 |
(6.10) |
Veličinu
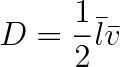 |
(6.11) |
nazýváme difuzní součinitel.
Toto odvození výrazu pro difúzní součinitel nebylo zcela přesné. Především není pravda, že v průměru dorazí molekuly beze srážky do průřezu, jímž tok počítáme, právě ze vzdálenosti rovné střední volné dráze. To platí pouze pro molekuly, které se pohybují ve směru osy trubice. Neuvažovali jsme též okolnost, že při difúzi je preferován určitý směr rychlosti. Přesněji výpočty Chapmana (1915) a Enskoga (1917), při kterých mimo jiné byly uvažovány molekuly jako hmotné body působící na sebe silami nepřímo úměrnými i-té mocnině (i > 5) vzdálenosti, vedly k výsledku, že
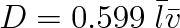 |
Podstatné zůstává, že difúzní součinitel je určen součinem střední volné dráhy a střední rychlosti.
Difuze může probíhat samozřejmě v libovolném systému a proto platí obecně
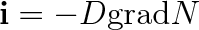 |
(6.2) |
Jak jsme uvedli v článku 6.2, je střední volná dráha molekul dusíku či kyslíku ve vzduchu při normálním tlaku asi 1 . 10-7 m. Střední rychlost těchto molekul je při pokojové teplotě asi 400 m.s-1 Ze vztahu (6.11) pak vyplývá hodnota difúzního součinitele D = 2 . 10-5 m2 . s-1 = = 0,2 cm2 . s-1. Naměřené hodnoty difúzního součinitele pro dusík N2 či kyslík 02 jsou 0,18 cm2 . s-1.
Nepřihlížíme-li k teplotní závislosti srážkového průřezu, dané Sutherlandovým vzorcem (6.7), měl by se difúzní součinitel zvyšovat při konstantním objemu úměrně odmocnině z teploty, což je dáno teplotní závislostí střední rychlosti (viz vztahy (5.65)). Při konstantní teplotě bude difúzní součinitel nepřímo úměrný hustotě molekul, a tím i tlaku. Při konstantním tlaku je hustota molekul nepřímo úměrná druhé mocnině střední hodnoty rychlosti
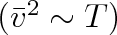 , takže difúzní součinitel se bude zvyšovat úměrně T1/2.
, takže difúzní součinitel se bude zvyšovat úměrně T1/2.
Teplotní závislost koeficientu difúze určuje tzv. termodifúzi. K termodifúzi dochází v homogenní směsi plynů, je-li v ní gradient teploty. Molekuly lehčího plynu se pak přednostně pohybují ve směru gradientu teploty, to jest ve směru vzrůstu teploty. Molekuly těžšího plynu se pohybují opačným směrem. Teplejší vrstvy plynu jsou proto obohaceny plynem s lehčími molekulami, studenější těžšími. Toho lze využít k separaci (oddělování) molekul.
Difúze není jev, který by byl vázán pouze na plyny. Vztah (6.11) platí přibližně i pro kapaliny. Za normálních podmínek je střední volná dráha v kapalinách asi o šest řádů nižší, tomu odpovídá i úměrně nižší hodnota difúzního součinitele
Tabulka 6-1 Hodnoty difúzních součinitelů D některých směsí
|
Difundující |
Difúzní |
D (m2 . s-1) |
Teplota |
|
látka |
prostředí |
T(°C) |
|
|
H2 |
N2 |
6,74 . 10-5 |
0 |
|
H2 |
o2 |
6,97 . 10-5 |
0 |
|
H2 |
vzduch |
6,11 . 10-5 |
0 |
|
o2 |
N2 |
1,81 . 10-5 |
0 |
|
NH3 |
vzduch |
1,98 . 10-5 |
0 |
|
NaCl |
voda |
1,24 . 10-9 |
18 |
|
HC1 |
voda |
3,13 . 10-9 |
20 |
|
C2H5OH |
voda |
1,01 . 10-9 |
20 |
|
Au |
Cu |
2,9. 10-16 |
550 |
|
Au |
Ge |
5,0 . 10-14 |
800 |
|
Au |
Si |
3,0. 10-11 |
1 300 |
|
Pb |
Pb |
2,1 . 10-24 |
20 |
|
Pb |
Pb |
5,8 . 10-18 |
165 |
|
Pb |
Pb |
6,7. 10-14 |
320 |
(viz tab. 6-1). V pevných látkách je situace složitější, kinetický model, který jsme používali pro plyn, je obtížně aplikovatelný. Difúzní součinitel se však s teplotou mění obdobně jako v plynu. Jeho zvýšení s teplotou se využívá při implantaci příměsových atomů, což je základem technologie výroby polovodičů. Termodi-fúze se naopak využívá při čištění látek.