a molární tepelné kapacity víceatomových molekul
Střední kinetická energie Ek1 jedné jednoatomové molekuly bude NA-krát menší, než je kinetická energie 1 molu plynu. Z rovnice (5.33) proto plyne
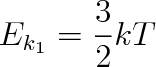 |
(5.35) |
Jednoatomová molekula plynu má tři stupně volnosti, neboť její poloha v prostoru je jednoznačně určena třemi souřadnicemi. Její pohyb je chaotický, žádný směr není preferován. Můžeme proto předchozí vztah vyjádřit tak, že na každý stupeň volnosti jednoatomové molekuly přísluší střední hodnota kinetické energie kT/2. Tato formulace představuje nejjednodušší vyjádření ekvipartičního teorému.
Dvouatomová molekula má 5 stupňů volnosti, neboť jeden ze šesti stupňů volnosti, které mají dva nezávislé atomy, se „spotřebuje" na vazebnou podmínku stanovující vzdálenost za pevně danou, což znamená, že atomy v molekule tvoří pevný, rigidní systém. Dvouatomová molekula by pak měla 3 translační a 2 rotační stupně volnosti. Připadá-li na každý stupeň volnosti energie kT/2, měla by dvouatomová molekula mít kinetickou energii rovnou
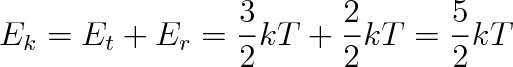 |
(5.37) |
Molární tepelná kapacita při konstantním objemu CmV by pak byla CmV = 5 R/2, při konstantním tlaku
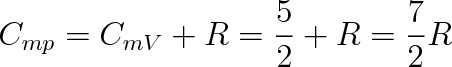 |
(5.38) |
Tabulka 5-4 Molární tepelné kapacity (a další veličiny) víceatomových plynů při 300 K
|
Plyn |
Cmp(J.mol-1. K-1) |
|
I (10-47kg.m2) |
Tr(K) |
TV(K) |
|
vodík H2 |
28,84 |
1,41 |
0,47 |
85,3 |
5 995 |
|
kyslík O2, |
29,37 |
1,398 |
19,2 |
2,1 |
2 238 |
|
chlor Cl2 |
33,87 |
1,35 |
113 |
0,36 |
801 |
|
dusík N2 |
29,12 |
1,401 |
13,8 |
2,92 |
3 352 |
|
chlorovodík |
|||||
|
HC1 |
29,13 |
1,39 |
2,641 |
15,34 |
4 160 |
|
voda H20 |
33,55 |
1,334 |
1,022 |
39,4 |
5 258 |
|
1,918 |
21,0 |
2 293 |
|||
|
2,940 |
13,7 |
5 400 |
|||
|
oxid uhličitý CO2 |
37,21 |
1,293 |
70,6 |
0,57 |
961 1 924 3 379 |
|
čpavek NH3 |
35,65 |
1,305 |
2,78 |
14,5 |
2 344 |
|
2,78 |
14,5 |
1 356 |
|||
|
4,33 |
9,34 |
4 794 4 910 |
V tabulce 5-4 uvádíme hodnoty Cmp a
 pro několik dvojatomových molekul. Hodnoty byly měřeny při teplotě kolem 20 °C.
pro několik dvojatomových molekul. Hodnoty byly měřeny při teplotě kolem 20 °C.
Předpokládaná hodnota Cmp má být 29,1 J . K-1 . mol-1. Poissonova konstanta
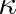 = 1,4.
= 1,4.
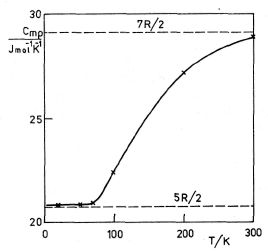
Zdůrazňujeme, že hodnoty byly stanoveny při pokojové teplotě. Podle kinetické teorie by měly být molární tepelné kapacity nezávislé na teplotě. Experiment však tento závěr nepotvrzuje. Na obr. 5-4 je zakreslena naměřená závislost molární tepelné kapacity Cmp vodíku H2 na teplotě pro nízké teploty. Z grafu je
 Obr. 5-4
Obr. 5-4
zřejmé, že se snižující se teplotou se zmenšují hodnoty Cmp až na hodnotu 5R/2 předpovězenou kinetickou energií pro jednoatomový plyn. V teplotním oboru 20 K až 70 K se molární tepelná kapacita Cmp vodíku nemění a zůstává rovna přibližně 5R/2. Nemění se ani při přechodu vodíku do kapalného stavu, který se za normálního tlaku uskuteční za teploty 24,28 K. Znamená to, že při nízkých teplotách asi do 70 K se dvouatomový vodík chová jako ideální jednoatomový plyn a vnitřní energie je určena prakticky jen translačním pohybem molekul. S rostoucí teplotou se však začne uplatňovat příspěvek rotačního pohybu ke zvýšení vnitřní energie plynu, a tím i jeho molárních tepelných kapacit.
Vysvětlit tento efekt v rámci klasické mechaniky a z ní vycházející kinetické teorie nelze. Uděláme proto krátkou odbočku z klasické do kvantové mechaniky, abychom ve značně zjednodušeném výkladu tento problém vysvětlili.
Podle kvantové mechaniky hodnoty energie rotující molekuly nemohou být libovolné a jsou určeny vztahem (viz např. [2])
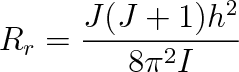 |
(5.39) |
ve kterém znamená J rotační kvantové číslo, které může nabývat hodnot přirozených čísel nebo být rovné nule (J = 0, 1, 2 atd.), I je moment setrvačnosti molekuly. Při J = 0 bude Er = 0, takže rotace molekuly může být příčinou zvýšení vnitřní energie plynu, je-li alespoň J = 1. Pak bude platit
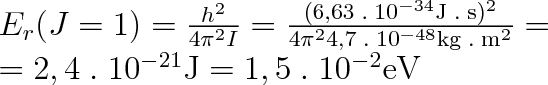 |
(5.40) |
Aby se vybudil rotační pohyb molekuly, musí její energie být rovna alespoň této hodnotě. Energie translačního pohybu molekuly je srovnatelná s hodnotou kT. Bude-li Er(J = l)
 kT, rotační pohyb se nevybudí, naopak při Er(J=l) < kT bude rotovat téměř každá molekula. Protože k = = 1,38 . 10-23 J .K-1 = 8,62 . 10-5 eV . K-1, bude při pokojové teplotě T = 300 K hodnota kT = 2,58 . 10-2 eV a rotační pohyb bude vybuzen. Při teplotě 70 K je kT = 6 . 10-3 eV, což je hodnota podstatně menší než energie první rotační hladiny, a pravděpodobnost, že molekula náhodně získá energii Er(J = 1), je velmi malá. Příspěvek rotačního pohybu k celkové vnitřní energii je proto při nízkých teplotách nepatrný. Nakolik odpovídají tyto představy realitě, můžeme porovnat s hodnotami uvedenými v grafu na obr. 5-4.
kT, rotační pohyb se nevybudí, naopak při Er(J=l) < kT bude rotovat téměř každá molekula. Protože k = = 1,38 . 10-23 J .K-1 = 8,62 . 10-5 eV . K-1, bude při pokojové teplotě T = 300 K hodnota kT = 2,58 . 10-2 eV a rotační pohyb bude vybuzen. Při teplotě 70 K je kT = 6 . 10-3 eV, což je hodnota podstatně menší než energie první rotační hladiny, a pravděpodobnost, že molekula náhodně získá energii Er(J = 1), je velmi malá. Příspěvek rotačního pohybu k celkové vnitřní energii je proto při nízkých teplotách nepatrný. Nakolik odpovídají tyto představy realitě, můžeme porovnat s hodnotami uvedenými v grafu na obr. 5-4.
[2] Beiser, A., Úvod do moderní fyziky, Academia, Praha 1975.
Jsou-li přípustné jen určité diskrétní hladiny rotační energie, budou přípustné též jen diskrétní kmitočty rotace molekuly. Protože
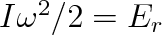 , přísluší nejnižší hladině rotační energie kmitočet
, přísluší nejnižší hladině rotační energie kmitočet
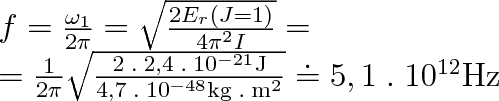 |
Při této frekvenci lze nalézt ve spektru vodíku emisní nebo absorpční spektrální čáru, která přísluší přechodu ze základní (J = 0) na první hladinu rotační energie.
Moment setrvačnosti dvouatomové molekuly vzhledem k podélné ose symetrie je, jak jsme již uváděli, asi 104krát menší. Aby se vybudil tento rotační pohyb, musela by molekula získat energii řádu 102 eV. K tomu jsou potřebné teploty kolem 106 K. Při těchto teplotách by však molekula disociovala, neboť její energie vazby je pouze 4,72 eV.
Molekula vodíku je nejmenší realizovatelná dvouatomová molekula. Přísluší jí nejmenší moment setrvačnosti, a tím podle (5.37) nejvyšší hladiny rotační energie. Například molekula oxidu uhelnatého CO má Er(J = 1) = = 4,75 . 10-4 eV a rotační pohyb by byl vybuzen již při teplotě 5 K. Vzhledem k tomu, že bod varu je 191,6 K, může se u tohoto plynu vždy vybudit rotační pohyb. S jistým omezením týkajícím se především malých molekul za nižších teplot můžeme ekvipartiční princip zobecnit i na dvojatomové molekuly a nadále tvrdit, že na každý stupeň volnosti připadá v průměru energie kT/2.
Při teplotách okolo 300 K se mění molární tepelná kapacita vodíku H2 jen málo a je přibližně rovna hodnotě 7R/2, předpovězené ekvipartičním teorémem. Experiment však ukazuje, že se molární tepelné kapacity s rostoucí teplotou dále zvyšují. Ani předchozí formulace ekvipartičního teorému není proto udržitelná.
Zůstává nám k dispozici jeden stupeň volnosti, který jsme prozatím vyřadili z úvah předpokladem, že vzdálenost mezi atomy je pevná. Otázkou meziatomo-vých sil se budeme podrobněji zabývat v kapitole 7. Vrátíme se zatím k obrázku 1-10, na kterém je znázorněn graf závislosti potenciální energie dvouatomové molekuly na mezijaderné vzdálenosti r. Graf této závislosti je komplikovaný, ale v okolí minima jej můžeme aproximovat parabolou, takže lze psát
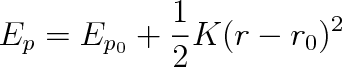 |
(5.41) |
kde r0 je délka vazby (viz čl. 1.2). Velikost meziatomové síly je rovna záporně vzaté derivaci Ep podle vzdálenosti, takže
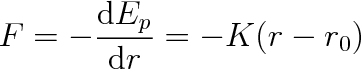 |
(5.42) |
Takováto síla úměrná výchylce z rovnovážné polohy působí například na napjatou nebo stlačenou pružinu. Můžeme proto modelovat molekulu jako dvě kuličky (obr. 5-5) spojené pružinou s tuhostí K. Tento oscilátor koná netlumené
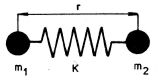 Obr. 5-5
Obr. 5-5
harmonické kmity s frekvencí
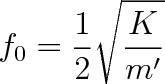 |
(5.43) |
kde m' je redukovaná hmotnost oscilátoru. Pro jednu kuličku o hmotnosti m zavěšenou na pružině je m' = m. Pro dvoutělesový oscilátor s kuličkami o hmotnostech m1 a m2 bude
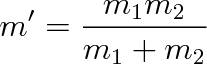 |
(5.44) |
Z klasické mechaniky plyne, že celková mechanická energie tohoto oscilátoru je rovna součtu kinetické a potenciální energie kmitajících kuliček
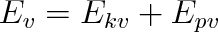 |
Tato energie může podle klasické mechaniky nabývat libovolných hodnot. V klasickém přiblížení by se tyto kmity projevily při jakékoliv teplotě. Kvantová mechanika však opět připouští jen diskrétní hladiny energie
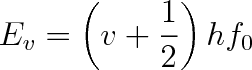 |
(5.45) |
neboť kvantové vibrační číslo v může nabývat jen hodnot nezáporných celých čísel. Nejnižší vibrační stav je pro
 a energie má hodnotu hf0/2 (h je Planckova konstanta f0 je dáno vztahem (5.43)). Tato energie je nezávislá na teplotě a nepřispívá ke zvýšení molární tepelné kapacity. Vzdálenost mezi sousedními vibračními hladinami je
a energie má hodnotu hf0/2 (h je Planckova konstanta f0 je dáno vztahem (5.43)). Tato energie je nezávislá na teplotě a nepřispívá ke zvýšení molární tepelné kapacity. Vzdálenost mezi sousedními vibračními hladinami je
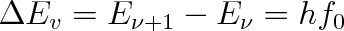 |
(5.46) |
Pro vodík H2 je K = 573 N . m-1 (lze stanovit spektroskopicky), takže dostaneme
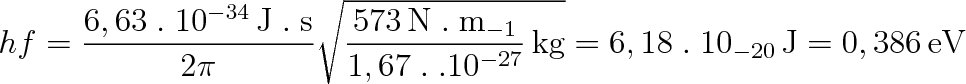 |
Vzdálenost mezi vibračními hladinami je o víc než jeden řád větší než vzdálenost mezi rotačními hladinami. Bude proto potřeba o více než řád vyšší teplota k vybuzení molekuly do jiného než základního vibračního stavu. Pokud je
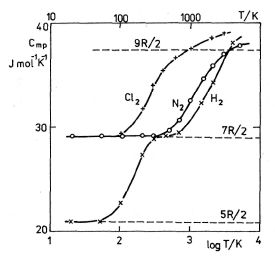 Obr. 5-6
Obr. 5-6
hf0 > kT, existuje jen nepatrná pravděpodobnost, že vibrační energie molekuly bude jiná než při termodynamické teplotě blízké 0 K. Vzdálenost vibračních hladin bude u vodíku srovnatelná s energií tepelného pohybu při teplotách kolem 4 000 K. Někde u této teploty začíná „plató" v teplotní závislosti Cmp (viz obr. 5-6).Hodnota Cmp při poměrně vysokých teplotách kolem 4 000 K je přibližně 9R/2. Znamená to, že na vibrační stupeň volnosti připadá u jedné molekuly v průměru hodnota energie rovná kT a nikoliv kT/2 jako u ostatních stupňů volnosti. Zdůvodnit to můžeme tím, že u kmitajícího tělesa musíme počítat jak s kinetickou, tak i s potenciální energií. Kinetická energie harmonického oscilátoru je úměrná druhé mocnině úhlové rychlosti, potenciální energie druhé mocnině výchylky. Na základě těchto poznatků můžeme vyslovit obecně platnou formulaci ekvipartičního teorému:
Na každý kvadratický člen určující energii molekuly připadá v průměru energie kT/2.
K této formulaci dodejme, že tato průměrná energie přispěje k molární tepelné kapacitě, je-li příslušný pohyb vybuzen.
Na obr. 5-6 je vynesena teplotní závislost molárních tepelných kapacit tří dvouatomových plynů. Pro zvýšení názornosti jsme na vodorovné ose použili logaritmické měřítko. S teplotní závislostí Cmp vodíku H2 zde porovnáme závislost molárních tepelných kapacit dusíku N2 a chloru Cl2. Je zřejmé, že rotační i vibrační pohyb u obou těchto molekul se vybudí při podstatně nižších teplotách. Důvodem je větší hmotnost i moment setrvačnosti těchto molekul. S výjimkou vodíku je u všech molekul již při teplotě varu vybuzen rotační pohyb a jejich molární tepelná kapacita Cmp je nejméně 7R/2. Jistý kvantitativní údaj o tom, Jsou-li vybuzeny rotační nebo vibrační pohyby v molekule, nám dávají teploty Tr a Tv, které určíme z rovnic (5.40), (5.46), položíme-li kTr = Er (J = 1) nebo Ev = kTv. Bude platit
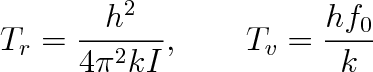 |
(5.47) |
V tabulce 5-4 jsou pro řadu plynů nejen dvouatomových uvedeny hodnoty molárních tepelných kapacit Cmp a Poissonovy konstanty x změřené při teplotě 300 K. Zároveň jsou udány i momenty setrvačnosti I a teploty Tr a Tv. Ve víceatomové molekule se uskutečňují různé typy vibrací a momenty setrvačnosti kolem tří hlavních os jsou obecně různé. Tomu odpovídá i příslušný počet momentů setrvačnosti a teplot Tr
Položme si ještě otázku, jakou největší molární tepelnou kapacitu by měl mít víceatomovýplyn, Jsou-li vybuzeny všechny pohyby v molekule. Soubor N atomů v molekule má 3N stupňů volnosti, tři pro každý atom. Tři stupně volnosti potřebujeme na popis postupného pohybu těžiště molekuly. U nelineární molekuly. další tři na rotaci molekuly kolem těžiště. U lineární molekuly pouze dva. Zbývající stupně volnosti přísluší vibracím. U nelineární molekuly bude počet vibračních stupňů roven 3N - 6, u lineární molekuly 3N - 5. Přísluší-li na každý translanč-ní a rotační stupeň volnosti v průměru na jednu molekulu energie kT/2, bude tento příspěvek pro 1 mol plynu činit 6RT/2 nebo 5RT/2. Příspěvek na jeden vibrační stupeň bude RT, takže molární tepelné kapacity víceatomové nelineární molekuly (N
 3) budou rovny
3) budou rovny
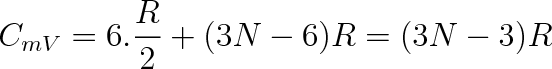 |
(5.48a) |
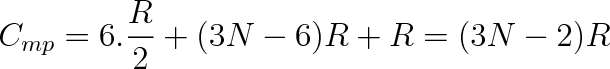 |
(5.48b) |
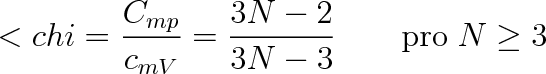 |
(5.48c) |
Pro lineární molekuly budou tepelné kapacity o R/2 větší. Vztahy (5.48a, b, c) platí jen při tak vysokých teplotách, při nichž je v průměru u všech molekul vybuzena alepoň první vibrační hladina s vibračním kvantovým číslem
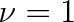 .
.