Celková kinetická energie translačního pohybu N molekul, každé o hmotnosti m0 je rovna
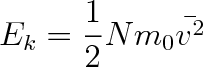 |
S použitím výrazu pro Ek můžeme psát rovnici (5.24) ve tvaru
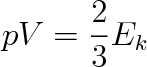 |
(5.32) |
Jedná-li se o plyn, jehož chování lze popsat stavovou rovnicí ideálního plynu pV = nRT, kde n je látkové množství plynu, musí se pravá strana (5.32) rovnat nRT, takže
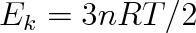 |
(5.33) |
Kinetická energie translančního pohybu plynu je tedy jednoznačnou funkcí teploty. Rovnice (5.32) je vyjádřením Boyleova-Mariottova zákona s tím, že konstanta, jíž je roven součin pV, je interpretována jako 2/3 celkové kinetické energie translančního pohybu molekul.
V tabulce 5-2 uvádíme pro několik plynů, jak se relativně mění při konstantní teplotě 0 °C hodnota součinu pV. Za referenční hodnotu tlaku je brána hodnota p0 = 101,3 kPa. Přibližně s tou přesností, s jakou zůstává hodnota pV/p0V0 konstantní, platí tvrzení, že se neuplatňuje silové působení molekul a že potenciální energie vyplývající z tohoto působení je nulová.
Tabulka 5-2 Stlačitelnost plynů
|
Relativní tlak p/p0 |
pV/p0V0 |
||||
|
N2 |
He |
H2 |
O2 |
co2 |
|
|
~0 1 10 100 1 000 |
1,000 5 1,000 0 0,996 1 0,986 6 2,068 |
0,999 5 1,000 0 1,004 7 1,051 9 1,483 8 |
0,999 4 1,000 0 1,005 6 1,064 1 1,709 |
1,001 0 1,000 0 0,991 0,923 1,74 |
1,006 8 1,000 0 0,202 1,656 |
V jednoatomové molekule se nemohou uplatnit vnitřní pohyby a rotace molekuly by neměla zvýšit znatelně její kinetickou energii.
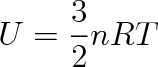 |
(5.34) |
Získaný výsledek lze poměrně snadno porovnat s experimentálními výsledky. Tato konfrontace ověří správnost kinetické teorie plynů.
Víme , že molární tepelná kapacita plynu při konstantním objemu CmV je rovna derivaci molární vnitřní energie podle termodynamické teploty. Tedy pro látkové množství n = 1 mol plyne z (5.34)
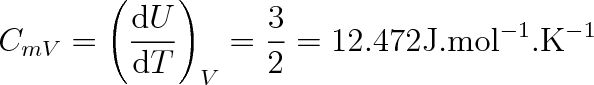 |
Podle Mayerova vztahu (viz (3.19b)) je molární tepelná kapacita při konstantním tlaku Cmp větší než CmV, a to o hodnotu R, takže
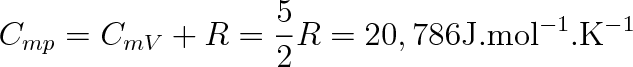 |
Poměr Cmp/CmV se nazývá Poissonova konstanta
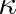 . (viz vztah (3.20)), pro jednoatomový plyn předpovídá teorie hodnotu
. (viz vztah (3.20)), pro jednoatomový plyn předpovídá teorie hodnotu
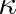 = 5/3 = 1,66. Z trojice veličin CmV, Cmp,
= 5/3 = 1,66. Z trojice veličin CmV, Cmp,
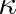 lze přesněji změřit poslední dvě. Metody měření jsou popsány například v učebnici [3]. Molární tepelná kapacita při stálém objemu se měří obtížněji, neboť hmotnost plynu v nádobě rozumných rozměrů je za běžných tlaků dosti malá. Určuje se proto CmV jako poměr
lze přesněji změřit poslední dvě. Metody měření jsou popsány například v učebnici [3]. Molární tepelná kapacita při stálém objemu se měří obtížněji, neboť hmotnost plynu v nádobě rozumných rozměrů je za běžných tlaků dosti malá. Určuje se proto CmV jako poměr
 .
.
Hodnoty Cmp a
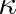 naměřené za normálních podmínek pro některé jednoatomové plyny uvádíme v tab. 5-3. Souhlas teorie s experimentem je velmi dobrý. Rozdíly jsou ve všech uváděných případech menší než 2 %. Tento výsledek je jedním z hlavních úspěchů kinetické teorie plynů a potvrzuje představu, že vnitřní energie jednoatomového plynu je určena celkovou kinetickou energií translančního pohybu atomů.
naměřené za normálních podmínek pro některé jednoatomové plyny uvádíme v tab. 5-3. Souhlas teorie s experimentem je velmi dobrý. Rozdíly jsou ve všech uváděných případech menší než 2 %. Tento výsledek je jedním z hlavních úspěchů kinetické teorie plynů a potvrzuje představu, že vnitřní energie jednoatomového plynu je určena celkovou kinetickou energií translančního pohybu atomů.
Tabulka 5-3 Molární tepelné kapacity Cmp a Poissonova konstanta
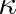 jednoatomových plynů.
jednoatomových plynů.
|
Plyn |
Cmp (J.mol-1.K-1) |
|
|
argon Ar |
20,89 |
1,648 |
|
helium He |
20,94 |
1,63 |
|
krypton Kr |
20,79 |
1,689 |
|
neon Ne |
20,79 |
1,642 |
|
xenon Xe |
20,79 |
1,666 |
|
dusík N |
20,79 |
- |
|
kyslík O |
21,9 |
- |