Nechť se plyn nachází v jiném než rovnovážném stavu. Při nádoby na dvě poloviny poznáme nerovnovážný stav tak, že v jedné polovině nádoby je více molekul než v druhé. Takovýto stav je realizován menším počtem mikrostavů, než rovnovážný stav, při němž je v každé polovině nádoby n = N/2 molekul. Kombinační faktor N!/n!(N - n)! je největší právě pro n = N/2. Je-li plyn, který byl v nerovnovážném stavu, ponechán samovolnému vývoji, vyrovnají se počty molekul v obou polovinách nádoby a systém přejde do rovnovážného stavu. Vyrovnání počtu molekul je možno si představit tak, že systé prochází řadou mezistavů (makrostavů). Počet mikrostavů, kterými je možno následující stav realizovat je vždy větší. Opačný vývoj, který by vedl ke zvětšování odchylky od rovnovážného stavu, je
nepravděpodobný. V termodynamice bylo ukázáno (str. 86), že při nevratném ději entropie roste a dosahuje maxima v rovnovážném stavu. Počet mikrostavů i entropie vykazují při přechodu do rovnovážného stavu stejné vlastnosti. To vede k myšlence, že obě veličiny spolu souvisí. Pokud existuje funkční závislost entropie S makrostavu napočtu W mikrostavů, kterými jej lze realizovat, měla by mít tato závislost tvar
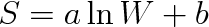 |
(5.49) |
K tomuto vyjádření lze dojít následující úvahou. Entropie je veličina aditivní, což znamená, že celková entropie dvou zcela nezávislých systémů, například dvou plynů uzavřených ve dvou různých nádobách na různých místech, je rovna součtu jejich entropií
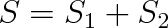 |
Počet mikrostavů je funkce multiplikativní. Máme-li k dispozici dva nezávislé systémy, jejichž makrostavy můžeme realizovat W1 a W2 mikrostavy, počet mikrostavů soustavy jako celku bude
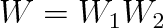 |
Bude-li entropie funkcí počtu mikrostavů, S = f(W), musí tato funkce splňovat podmínku
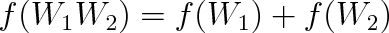 |
(5.50) |
která plyne z dvou předchozích vztahů. Podmínce (5.50) vyhovuje logaritmická funkce, neboť logaritmus součinu je roven součtu logaritmů. Nejjednodušším vyjádřením závislosti S = f(W) je pak vztah (5.49).
Konstanta a musí mít univerzální hodnotu. Stanovíme ji tak, že vypočítáme pro vhodně zvolený případ změnu entropie podle termodynamických vztahů a podle (5.49). Oba výpočty musí dát stejný výsledek.
S počítáme změnu entropie při izotermicé expanzi plynu o látkovém množství n a objemu V/2 na objem V.
Z měna entropie je rovna
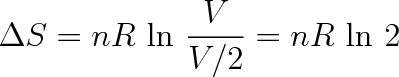 |
(5.51) |
Podle statistických představ, kdyby došlo k samovolné izotermické kompresi plynu do jedné poloviny nádoby, byla by podle (5.49) entropie tohoto makrostavu rovna
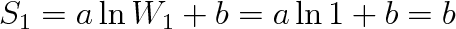 |
(5.52) |
Počet mikrostavů je dán kombinačním faktorem W = N!/n!(N - n)!a v tomto případě je buď n = N, nebo n = 0, takže W1 = N!/N! = 1. Po expanzi bude v rovnovážném stavu v každé polovině nádoby NA/2 molekul a platí
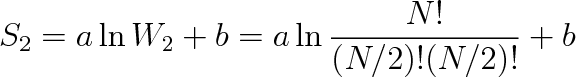 |
(5.53) |
Dá se ukázat, že tentovztah lze upravit na
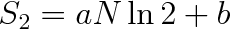 |
Výraz (5.53) pro entropii je poněkud nepřehledný a upravíme ho použitím přibližného výrazu pro ln n!.
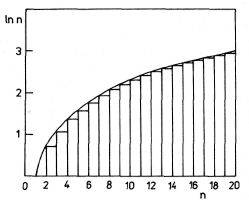 Obr. 5-7
Obr. 5-7
Pro velké počty sčítanců je možno sumy v předchozím výrazu nahradit integrály. Geometricky to znamená, že plochu pod stupínkovitou křivkou na obr. 5-7 (odpovídá ln n!) nahradíme plochou pod hladkou křivkou Y = ln x. Pro n
 1 je rozdíl mezi oběma křivkami těžko rozeznatelný. Proto
1 je rozdíl mezi oběma křivkami těžko rozeznatelný. Proto
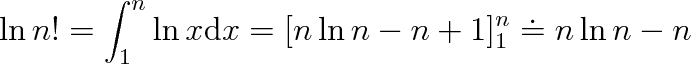 |
(5.54) |
Toto přibližné vyjádření ln n! se ve statistice často používá a představuje zjednodušení Stirlingovy formule. Do výrazu (5.53) dosadíme za ln N! a ln (N/2)! podle (5.54) a dostaneme
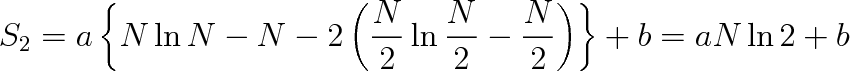 |
Změna entropie při expanzi plynu bude
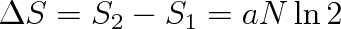 |
(5.55) |
Protože N = nNA a plynová konstanta R = kNA, budou výrazy (5.55) a (5.51) stejné, bude-li a rovno Boltzmannově konstantě, (a = k).
Entropie je v termodynamice určena až na aditivní konstantu, a proto není hodnota b důležitá.