Matematické formulace druhého termodynamického zákona pro vratné děje využijeme k zavedení další funkce. Zvolme v průběhu cyklického děje podle obr. 4-8 dva stavy (1) a (2). Probíhá-li děj ze stavu (l) cestou I do stavu (2) a ze stavu (2) cestou II zpět do stavu (l), a je-li na obou cestách děj vratný, platí
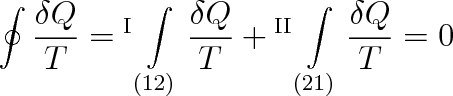 |
Obrátíme-li u druhého integrálu meze, dostaneme, že
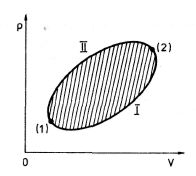 Obr. 4-8
Obr. 4-8
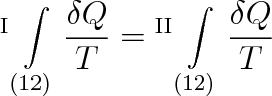 |
(4.19) |
Tento vztah dokazuje, že hodnota integrálu z
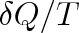 při vratné změně ze stavu (1) do stavu (2) není závislá na cestě, po níž děj probíhá, ale závisí pouze na obou stavech soustavy. V této souvislosti zavádíme stavovou funkci S, zvanou entropie. Její přírůstek při vratném ději je definován vztahem
při vratné změně ze stavu (1) do stavu (2) není závislá na cestě, po níž děj probíhá, ale závisí pouze na obou stavech soustavy. V této souvislosti zavádíme stavovou funkci S, zvanou entropie. Její přírůstek při vratném ději je definován vztahem
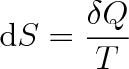 |
(4.13) |
Přejde-li soustava po libovolné vratné cestě ze stavu (1) do stavu (2), činí změna entropie
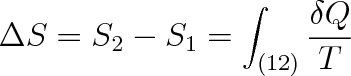 |
(4.14) |
kde S1 je hodnota entropie ve stavu (1), S2 hodnota entropie ve stavu (2).
Pro vratný cyklický děj je změna entropie (po libovolné uzavřené křivce)
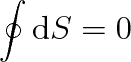 |
(4.15) |
Kdykoliv se integrál libovolného výrazu vzatý po uzavřené křivce rovná nule, je výraz za integračním znakem totálním diferenciálem nějaké stavové funkce. V souladu s tím je výraz
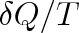 totálním diferenciálem entropie, přestože
totálním diferenciálem entropie, přestože
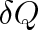 samo, jak jsme poznali v čl. 3.2, totálním diferenciálem není. Stává se jím teprve vynásobením integračním faktorem 1/T.
samo, jak jsme poznali v čl. 3.2, totálním diferenciálem není. Stává se jím teprve vynásobením integračním faktorem 1/T.
Podobně jako vnitřní energii je možno i entropii určit až na aditivní integrační konstantu. Entropie je dána vztahem
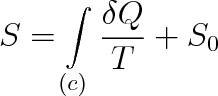 |
(4.16) |
v němž S0 je konstanta, představující hodnotu entropie v základním stavu, tj. při teplotě T0 = 0 K. Konstantu S0 je možno zvolit libovolně. Jak ukázal Planck, nejvýhodnější je pro ni hodnota nulová (viz dále čl. 4.8).
Entropie je právě tak jako vnitřní energie aditivní funkcí. To znamená, že se entropie soustavy složené z několika částí rovná součtu entropií těchto částí.
Entropie má pro druhý termodynamický zákon stejný význam jako vnitřní energie pro první termodynamický zákon. Obě tyto stavové funkce zůstávají konstantní u izolovaných soustav. Zatímco vnitřní energie se nemění, je-li soustava izolovaná a uzavřená, entropie zůstává konstantní při vratných změnách adiabatických. Proto vratné adiabatické děje jsou z hlediska entropie izentropic-ké (izoentropické). Této vlastnosti entropie užíváme s výhodou ke grafickému znázornění vratných cyklických dějů v tzv. tepelných diagramech. Jimi rozumíme diagramy v proměnných entropie, teplota - S, T. V těchto diagramech jsou izotermy a adiabaty přímky rovnoběžné s osami souřadnic (obr. 4-9). Izotermic-
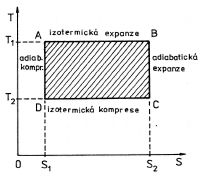 Obr. 4-9
Obr. 4-9
ká expanze je spojena s růstem entropie (S2 > S1), izotermická komprese s jejím poklesem. Adiabatické změny probíhají izentropicky, a to tak, že při expanzi teplota soustavy klesá (T2 < T1), při kompresi roste. Zatímco diagram p, V udává obsahem uzavřené plochy práci W', vykonanou při cyklickém ději po vyznačené cestě, v diagramu T, S je obsah uzavřené plochy rovný teplu
Q1 - Q'2 , které soustava získá při cyklickém ději. V obou případech mají však veličiny p dV a T dS jednotku energie.
Vyjádříme-li v matematickém zápisu prvního termodynamického zákona (3.21) diferenciál
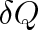 pomocí definičního vztahu (4.13) výrazem TdS, dostaneme pro libovolně malou vratnou změnu soustavy, u níž nedochází ke konání jiné práce než objemové (p dV), základní termodynamický vztah
pomocí definičního vztahu (4.13) výrazem TdS, dostaneme pro libovolně malou vratnou změnu soustavy, u níž nedochází ke konání jiné práce než objemové (p dV), základní termodynamický vztah
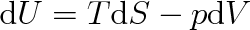 |
(4.17) |
Tento vztah představuje spojení prvního a druhého termodynamického zákona.
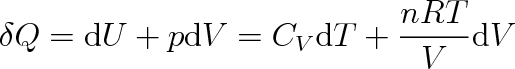 |
když jsme za p dosadili podle stavové rovnice (2.16). Z uvedené rovnice vychází pro libovolně malou změnu entropie
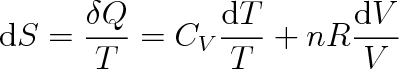 |
Konečná změna entropie ideálního plynu po přechodu ze stavu (1) do stavu (2) je dána vztahem
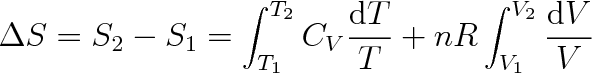 |
který za předpokladu, že CV není funkcí teploty, má tvar
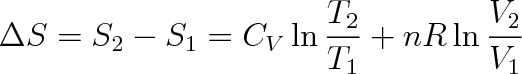 |
Mění-li se teplota plynu izochoricky (V = konst.), je změna entropie
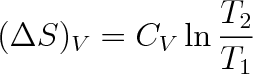 |
Např. pro jednoatomový ideální plyn (helium, argon, apod.) při izochorické změně mezi teplotami 200 °C a 0 °C činí změna entropie pro n = 1 mol
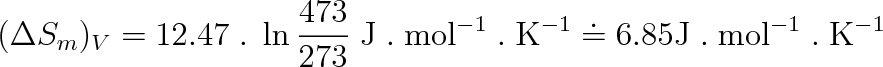 |
Expanduje-li ideální plyn izotermicky (T = konst.) např. na dvojnásobek svého objemu, změní podle výše uvedeného vztahu svou entropii o hodnotu (n = 1 mol)
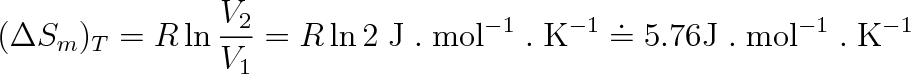 |
Při nevratném cyklickém ději, tj. při cyklu, jehož aspoň jedna část je nevratná, je
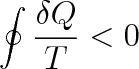 |
V tomto výrazu, zvaném Clausiova nerovnost, neznamená T teplotu soustavy, nýbrž teplotu lázně, s níž si soustava vyměňuje teplo. Pouze u vratných cyklických dějů je teplota T lázně totožná s teplotou soustavy.
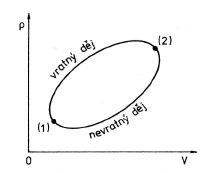 Obr. 4-10
Obr. 4-10
Uvažujme o cyklickém ději, při němž soustava přejde ze stavu (1) nevratnou změnou do stavu (2) a z něho vratnou změnou zpět do stavu (1), obr. 4-10. Tento cyklický děj je jako celek nevratný a podle nerovnosti (4.13) platí pro něj
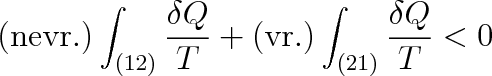 |
a po záměně mezí u druhého integrálu a jednoduché úpravě dostaneme
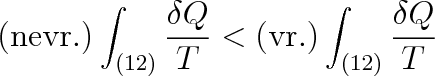 |
Poněvadž integrál po vratné cestě je podle rovnice (4.14) roven změně entropie
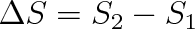 , platí při nevratných změnách nerovnost
, platí při nevratných změnách nerovnost
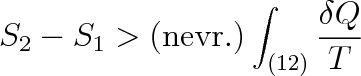 |
(4.18) |
V tepelně izolovaných soustavách, v nichž je zabráněno tepelné výměně s okolím, přejde nerovnost (4.18) v nerovnost
 |
(4.19) |
vyjadřující princip růstu entropie: Jestliže probíhá v tepelně izolované soustavě jakýkoliv nevratný děj, entropie soustavy roste. Konstantní zůstává jen tehdy, když děj v uvažované soustavě probíhá vratně. Mohou tedy v tepelně izolované soustavě probíhat jen takové děje, při nichž entropie soustavy neklesá.
V souvislosti s principem růstu entropie uvažujme o adiabaticky izolované soustavě, která není ve stavu termodynamické rovnováhy a má na různých místech různou teplotu a různý tlak. Různé teploty nebo tlaky se samovolně vyrovnávají a v soustavě probíhají nevratné děje, jež jsou doprovázeny růstem entropie soustavy Entropie soustavy roste tak dlouho, dokud nevratné děje spojené s vyrovnáváním teploty a tlaku neskončí a soustava nepřejde do rovnovážného stavu. Stav rovnováhy adiabaticky izolované soustavy se tedy vyznačuje tím, že entropie soustavy dosahuje při něm maximální hodnoty. Protože není možné, aby rovnovážný stav přešel sám od sebe do stavu nerovnovážného, nemůže entropie klesat. Podrobněji viz čl. 5.9.