Vpravíme-li do uzavřené prázdné nádoby kapalinu, přemění se část kapaliny v páru, která vyplní prostor nad kapalinou. Měříme-li tlak této páry, zjistíme, že nezávisí na vnitřních rozměrech nádoby a hmotnosti kapaliny v nádobě. Měření při různých teplotách ukáže, že tlak silně závisí na teplotě. Tlak naměřený v daném uspořádání nazýváme tlakem syté páry.
Tabulka 8-5 Teploty a tlaky syté páry různých látek
|
Látka |
Tlak |
sytých par |
PS (Pa) |
||||
|
Teplota r(K) |
|||||||
|
1,33 . 10-8 |
1,33 . 10-6 |
1,33 . 10-4 |
1,33 . 10-2 |
1,33 |
1,33 . 102 |
1,33 . 104 |
|
|
helium |
1,268 |
2,85 |
|||||
|
dusík |
23,7 |
27 |
31,4 |
37,5 |
47,0 |
63,4 |
|
|
kyslík |
29,2 |
31,9 |
36,7 |
43,3 |
54,1 |
74,3 |
|
|
oxid uhličitý |
76,1 |
85,7 |
98,1 |
114,5 |
137,5 |
173 |
|
|
voda |
144,5 |
162 |
185 |
215 |
256 |
324 |
|
|
rtuť |
184 |
205 |
231 |
267 |
319 |
398 |
527 |
|
hliník |
824 |
917 |
1 039 |
1 200 |
1 421 |
1 745 |
2 269 |
|
cín |
855 |
961 |
1 096 |
1 275 |
1 521 |
1 890 |
2 518 |
|
železo |
1 019 |
1 131 |
1 271 |
1 453 |
1 698 |
2 063 |
2 633 |
|
wolfram |
2 154 |
2 383 |
2 667 |
3 029 |
3 502 |
4 147 |
5 083 |
Závislost hustoty Nv molekul na jejich energii U dává Boltzmannův vztah, podle kterého
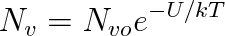 |
(8.15) |
Zde znamená Nvo hustotu molekul při U = 0, k je Boltzmannova konstanta a T termodynamická teplota.
Tento vztah můžeme použít k výpočtu teplotní závislosti tlaku syté páry. Energie molekul v plynném skupenství je vyšší než v kapalině. Pro látkové
množství 1 mol je molární skupenské teplo výparné Lm. Jedna molekula v plynu má proto v průměru o Lm/NA vyšší energii než v kapalině, je-li NA Avogadrova konstanta. Porovnáme-li změnu hustoty molekul vůči kapalině (U = 0; Nvo = Nk), bude v plynu Nv = Np a U = Lm/NA. Po dosazení do (8.15) dostaneme, že
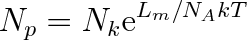 |
(8.16) |
Hustota molekul plynu souvisí s tlakem vztahem p = N kT . Uvážíme-li ještě, že kNA je rovno molární plynové konstantě R, dostaneme pro tlak plynu nad kapalinou
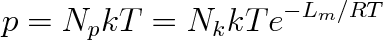 |
Po logaritmování dostaneme výraz
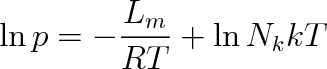 |
(8.17) |
Druhý člen na pravé straně této rovnice se mění s teplotou pomaleji než první, je možné tuto závislost zanedbat a pokládat jej za konstantu.
Na závěr tohoto článku se ještě krátce zmíníme o vodní páře v zemské atmosféře. Hmotnost vodní páry se mění v denní i roční době a závisí podstatně i na místě na Zemi. Větší hmotnost vodní páry je v ovzduší zpravidla odpoledne než
Tabulka 8-6 Teploty normálního bodu varu a teploty kritické
|
Kapalina |
Teplota kritická |
Teplota varu |
Tv/Tk |
|
Tk (K) |
Tv(K) |
||
|
voda H20 |
647 |
373 |
0,58 |
|
benzen C6H6 |
562 |
353 |
9,63 |
|
etylalkohol C2H5OH |
516 |
351 |
0,68 |
|
oxid siřičitý S02 |
431 |
263 |
0,61 |
|
sirovodík H2S |
373 |
213 |
0,57 |
|
oxid uhličitý C02 |
304 |
195 |
0,64 |
|
kyslík 02 |
155 |
90 |
0,58 |
|
dusík N2 |
126 |
77 |
0,61 |
|
vodík H2 |
33 |
20 |
0,61 |
ráno, v létě než v zimě, na pobřeží než ve vnitrozemí. Na hmotnosti vodní páry závisí četnost dešťových srážek i fyziologický pocit člověka. Lépe se snáší vyšší teplota při malé hmotnosti vodní páry. Zavedeme nyní některé veličiny, kterými se charakterizují vlastnosti vodní páry v ovzduší.
Absolutní vlhkost vzduchu
 je poměr hmotnosti m vodní páry ve vzduchu o objemu V a tohoto objemu, neboli
je poměr hmotnosti m vodní páry ve vzduchu o objemu V a tohoto objemu, neboli
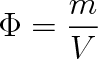 |
(8.21) |
Při dané teplotě nemůže být absolutní vlhkost vzduchu libovolně velká. Může vzrůstat jen do maximální hodnoty
 , při jejímž dosažení začne vodní pára kondenzovat. Stane se tak, je-li parciální tlak vodní páry roven tlaku syté vodní páry ps. Absolutní vlhkost a parciální tlak vodní páry jsou veličiny přibližně si úměrné, bude proto teplotní závislost maximální možné absolutní vlhkosti prakticky stejná jako teplotní závislost tlaku syté vodní páry.
, při jejímž dosažení začne vodní pára kondenzovat. Stane se tak, je-li parciální tlak vodní páry roven tlaku syté vodní páry ps. Absolutní vlhkost a parciální tlak vodní páry jsou veličiny přibližně si úměrné, bude proto teplotní závislost maximální možné absolutní vlhkosti prakticky stejná jako teplotní závislost tlaku syté vodní páry.
Lepší informaci o tom, jak je ovzduší vlhké, poskytuje veličina relativní vlhkost
 . Definujeme ji vztahem
. Definujeme ji vztahem
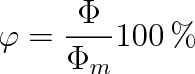 |
(8.22) |
Protože absolutní vlhkost
 je úměrná tlaku vodní páry, můžeme také psát
je úměrná tlaku vodní páry, můžeme také psát
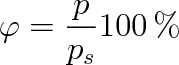 |
(8.23) |
znamená-li p parciální tlak vodní páry a ps tlak syté páry.
Vlhkost ovzduší je možno charakterizovat též rosným bodem. Je to stav popsaný teplotou Tr, na kterou by bylo třeba ochladit vzduch, aby tlak syté vodní páry v rosném bodě ps (TT) byl roven parciálnímu tlaku vodní páry při teplotě T; (ps(Tr) = p(T)).
[13] Brož J., Roskovec V., Valouch M.: Fyzikální a matematické tabulky, SNTL, Praha 1980