Dosud jsme se zabývali především vlastnostmi plynů, nebo jinak řečeno, látkami v plynném skupenství. Je to pochopitelné, neboť jejich vnitřní struktura, popis i vysvětlení jejich vlastností je nejjednodušší. Látky však mohou existovat i v kapalném a pevném skupenství*.
V této kapitole se budeme podrobněji zabývat otázkami změny skupenství látek. Jedná se o speciální případ obecněji chápaných fázových přechodů, o čemž pojednáme podrobněji v závěru této kapitoly. Nejprve věnujme pozornost stavovému diagramu jednosložkové soustavy.
Jednosložková soustava je tvořena částicemi (atomy, molekulami, ionty) jednoho typu, jediným chemickým individuem. K popisu této soustavy je nutno udat hodnoty jistých proměnných. Nepůsobí-li na soustavu vnější silová pole, jako např. pole elektrické či pole magnetické, volíme za proměnné z veličin jako je tlak, teplota, objem, případně vnitřní energie, entropie atd. K těmto tzv. stavovým veličinám musíme dodat jednu kapacitní veličinu, například látkové množství, jinak bychom nemohli určit například hmotnost látky. Tato kapacitní veličina však není pro další úvahy podstatná, neboť ke změně skupenství látky dochází za daného tlaku při stejné teplotě ať se jedná o jakoukoliv hmotnost látky.
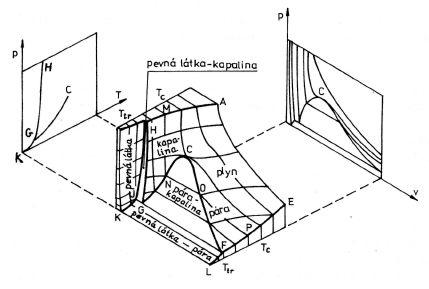
Ze stavových veličin však nemůžeme volit všechny za nezávislé veličiny. Předepíšeme-li pro jednosložkovou soustavu např. teplotu a tlak, je pro dané látkové množství látky jednoznačně určen její objem. Jednosložková soustava může mít tedy nanejvýš dva stupně volnosti. Říkáme, že je to soustava bivariantní. Její stav je určen (popsán) bodem na ploše v třírozměrném prostoru. Tato plocha je znázorněna ve střední části obrázku 8-1. Její tvar je poměrně komplikovaný, a není proto divu, že je obtížné nalézt explicitní funkci, která by tuto plochu popsala. Funkce by představovala stavovou rovnici.
* Silně ionizovaný plyn je možno pokládat za čtvrté skupenství látky - plazmatické. Plazmatického stavu lze dosáhnout například extrémním zvýšením teploty plynu. Srážky molekul pak nejsou pružné, dochází při nich k disociaci a ionizaci. Tímto skupenstvím se však zde zabývat nebudeme.
V pravé části obr. 8-1 je zakreslen dvourozměrný stavový diagram proměnných V a p. V něm jsou vyznačeny izotermy a oblast, v níž je v termodynamické rovnováze látka v rovnovážném stavu v plynném a kapalném skupenství. V levé části je pak diagram proměnných p a T. Izotermy by reprezentovaly svislé úsečky. V diagramu
 Obr. 8-1
Obr. 8-1
jsou také zakresleny křivky, podél kterých je v rovnováze látka ve dvou různých skupenstvích. Mezi body K a G pevná látka a pára, mezi G a C kapalina a plyn a mezi G a H pevná látka a kapalina. Grafy přísluší látkám, u kterých se při přechodu kapalina-pevná látka zmenšuje objem (např. oxid uhličitý).
Graf rovnovážných stavů mezi kapalným a plynným skupenstvím končí v bodě C, který reprezentuje kritický bod dané látky. Při teplotách vyšších než jsou kritické teploty se stírá rozdíl mezi plynným a kapalným skupenstvím. Při izotermickém stlačování plynu, jehož teplota je vyšší než kritická, se tlak i hustota plynu plynule zvyšuje. V žádném intervalu objemů se nevytvoří ostré rozhraní mezi látkou ve skupenství plynném a kapalném. Látka je neustále homogenní a nemůžeme rozhodnout, v jakém skupenství se nachází. Pro toto rozhodnutí nemáme žádné vhodné kritérium. Proto křivka GC na levém stavovém diagramu p, T v obrázku 8-1, která vyznačuje rovnovážné stavy mezi plynem a kapalinou, končí v kritickém bodě C.
Pod kritickou teplotou mohou existovat plyn i kapalina v oblasti vymezené křivkou procházející body G, C a F na obr. 8-1. Izotermy jsou v této oblasti vodorovné a změny objemu mezi body O a N korespondují se změnami podílů plynného a kapalného skupenství. Hustota kapaliny je vyšší než hustota plynu. Proto zaujímá látka dané hmotnosti tím menší objem, čím větší podíl má kapalné skupenství.
Tlak odpovídající vodorovným úsekům izoterm se nazývá tlak syté páry. Je-li při určité teplotě tlak v uzavřené nádobě menší než tlak syté páry, je veškerá látka v plynném skupenství. Naopak, je-li tlak větší, je všechna látka ve skupenství kapalném. Každé podkritické teplotě přísluší jediná hodnota tlaku syté páry dané látky. V uzavřené nádobě, v níž je v rovnováze plyn a kapalina stejného chemického složení, je tlak plynu při konstantní teplotě stále stejný, ať kapaliny je pouhá kapka nebo téměř naplňuje nádobu.
Tlak sytě páry je jednoznačnou funkcí teploty. Podíl hmotnosti plynu a kapaliny je dán látkovým množstvím. Uvažovaná soustava má z termodynamického hlediska jediný stupeň volnosti. Říkáme, že je to soustava univariantní.
Jednosložková soustava je univariantní i v oblasti, ve které je v rovnováze látka v pevném a kapalném skupenství. Tato oblast je na obr. 8-1 vymezena křivkou procházející body C, H a J. Stejně jako při kondenzaci plynu, změna objemu nevyvolá změnu tlaku, ale pouze změnu podílu látky v pevném a kapalném skupenství. U látek, které mají větší hustotu v pevném skupenství, způsobí zmenšení objemu zvýšení podílu pevného skupenství. Takových látek je většina. Existují však i látky, které mají menší hustotu v pevném skupenství, než ve skupenství kapalném. Nejběžnější z nich je voda, dále např. bizmut a germanium. V oblasti rovnováhy pevného a kapalného skupenství pak zmenšení objemu způsobí zvýšení podílu u kapaliny.
Body J a F je určena tak zvaná trojná přímka. Podle ní mohou být v rovnováze všechna tři skupenství látek. Jelikož trojná přímka je částí izotermy, jíž přísluší určitá teplota Ttr a tlak syté páry je konstantní, znamená to, že soustava nemá žádný stupeň volnosti. Říkáme, že je to soustava invariantní. V tabulce 8-1 uvádíme termodynamické teploty Ttr a tlaky ptr, při kterých mohou být v rovnováze všechna skupenství téže látky. Jedná se o hodnoty stavových veličin v tak zvaném trojném bodě, reprezentovaném bodem G na obr. 8-1. Stav látky odpovídající trojnému bodu lze poměrně snadno realizovat. Toho se využívá v termometrii. Jako základní teplota termodynamické teplotní stupnice byla zvolena teplota trojného bodu vody (definitoricky 273,16 K), viz čl. 2.3 a 2.4. Trojné body řady dalších látek slouží jako definiční nebo referenční body mezinárodní praktické teplotní stupnice IPTS-68 (viz článek 7.9).
Tabulka 8-1 Teploty a tlaky sytých par v trojných bodech
|
Látka |
Teplota |
Tlak |
|
Ttr (K) |
ptr (kPa) |
|
|
normální vodík (75 % orthovodík + 25 % paravodík |
13,956 |
7,199 |
|
neon |
24,555 |
43,303 |
|
kyslík |
54,361 |
0,146 52 |
|
dusík |
63,148 |
12,521 6 |
|
voda |
273,16 |
0,615 3 |
|
difenyleter |
300,02 |
- |
|
kys. benzoová |
395,52 |
- |