Jak bylo ukázáno v kapitole 6.2, závisí střední volná dráha molekul / nepřímo úměrně na tlaku. Snižujeme-li tlak plynu v uzavřeném prostoru (tzv. vakuovém systému) od atmosférického tlaku počínaje, dojde v okamžiku, kdy tlak klesne pod hodnotu, při níž začne střední volná dráha převyšovat rozměr systému d, k podstatným změnám vlastností plynu. Klesne-li tlak tak, že bude splněna tzv. vysokovakuová podmínka
 |
(6.21) |
budou se molekuly i nabité částice (elektrony a ionty) pohybovat bez vzájemných srážek. Pouze na stěnách systému bude docházet k tzv. vnějším srážkám. Tato skutečnost ovlivní průběh transportních procesů. V předešlé části bylo odvozeno, že součinitel tepelné vodivosti plynů nezávisí na tlaku při středních tlacích, s tlakem však klesá v oboru tlaků stanovených podmínkou (6.21). Stejně je tomu tak i s viskozitou. Přenos impulsu ve vakuovém systému klesá s klesajícím tlakem. Praktickým důsledkem prve uvedeného procesu jsou tepelně izolační vlastnosti vakua, jak je známe z Dewarových nádob. Důsledkem druhého procesu je volný, molekulami plynu nebrzděný pohyb těles ve vakuovém systé-
mu, resp. v prostoru (ve vysokých vrstvách atmosféry, jak je dobře známo, se pohybují bez tření družice). Proudění plynu za podmínky (6.21) - tzv. molekulární proudění plynu - má zcela jiné vlastnosti, než proudění za atmosférického tlaku, při němž je určováno vzájemným třením jednotlivých vrstev plynu o tloušťce odpovídající střední dráze /. Při molekulárním proudění je veličina nazývaná proud plynu P měřená v jednotkách Pa . 1. s-1 dána vztahem (viz např.
[10])
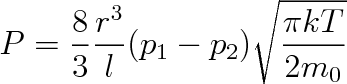 |
(6.22) |
v němž p1 a p2 jsou tlaky na koncích potrubí délky l kruhového průřezu o poloměru r, m0 hmotnost molekuly, T termodynamická teplota a k Boltzman-nova konstanta. Tato rovnice vyplývá z bilance sil, a to síly generující proudění a odpovídající rozdílu tlaků (p1 - p2) a tzv. vnějšího tření plynu na stěně potrubí. Proud plynu, jak je patrné z (6.22), nezávisí na viskozitě plynu, nýbrž na jeho teplotě a hmotnosti molekul. Pro molekulární proudění je příznačná závislost proudu plynu na třetí mocnině poloměru potrubí. U proudění viskózní-ho závisí na čtvrté mocnině poloměru. Proud plynu při molekulárním proudění nezávisí na absolutní hodnotě tlaku, závisí pouze na jeho spádu. Všechny tyto odlišnosti proudění molekulárního od viskózního mají význam pro průběh procesů ve vakuu a pro konstrukci vakuových aparatur.
Ve vakuových systémech při tlacích odpovídajících podmínce (6.21) se molekuly a ostatní částice (elektrony, ionty) pohybují bez vzájemných srážek, to jest pohybují se po přímkových trajektoriích, jejichž směr se mění jen ve srážkách se stěnou systému. Vliv gravitace na tvar trajektorie molekuly je při její velké střední rychlosti v systémech běžných rozměrů zanedbatelný. Tato skutečnost má velmi důležitý význam pro fyzikální přístroje a zařízení a přirozeně i pro technické a technologické aplikace (vakuová elektronika, elektronový mikroskop, urychlovač částic, vakuové naparování a další). Přitom je nutno mít na zřeteli, že ve vakuových systémech obvyklých rozměrů (řádově 10-1 m) je podmínka (6.21) splněna při tlacích, při nichž je hustota molekul značně velká - činí řádově 1018 m-3.
Při srážce molekuly plynu s povrchem stěny systému dochází k dalším velmi významným procesům. Mezi molekulou plynu a částicemi povrchu pevné látky dochází k velkému silovému působení. Je to proto, že jde vlastně o tytéž síly, jimiž jsou molekuly pevné (nebo kapalné) látky k sobě vázány; jde tedy o síly, jež jsou příčinou soudružnosti a pevnosti látky. U částic povrchu pevné látky nejsou tyto vazební síly nasyceny a nasycují se právě prostřednictvím vazby molekul plynu. Molekuly plynu vázané povrchem vytvářejí vrstvu plynu (tzv. adsorbovanou vrstvu) charakterizovanou povrchovou hustotou Ns Pro určitou pevnou látku, druh molekul plynu a teplotu existuje charakteristická doba pobytu t molekuly na stěně. Na stěnu dopadá za daných podmínek za sekundu určitý počet molekul N. Tyto molekuly na povrchu setrvávají v průměru po dobu z. Za stejnou dobu opouštějí povrch jiné molekuly, jejichž doba pobytu právě uplynula. Je-li vakuový
systém v rovnováze, jsou oba počty molekul stejné. Poněvadž počet molekul N dopadajících za sekundu na 1 cm2 je dán vztahem
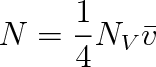 |
(6.23) |
v němž NV je hustota molekul, je souvislost mezi objemovou hustotou NV a povrchovou koncentrací Ns dána vztahem
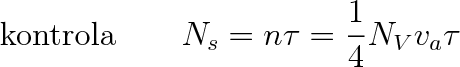 |
(6.24) |
Z toho je patrné, že při dostatečně nízkých tlacích, a tím při dostatečně malých hustotách NV, může být povrchová hustota velmi malá, zejména tehdy, je-li krátká doba pobytu
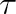 .
.
Je nutno si uvědomit, že na povrchu pevné látky se může vázat jen určitý počet molekul plynu, pokud mají být v přímé vazbě s povrchem (to je tzv. monomolekulární adsorpce). Na daném povrchu je k dispozici jen určitý počet adsorpčních míst, řádově 1014 až 1015 cm-1 pro nejběžnější případy povrchu a plynu. Tento počet tedy udává také povrchovou hustotu monomolekulární vrstvy
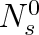 .
.
Všechny běžně dostupné povrchy jsou vystaveny dopadu molekul naší atmosféry. Při atmosférickém tlaku je počet dopadů molekul řádově 1023 cm-2. s-1. Proto jsou tyto povrchy vždy pokryty adsorbovanou vrstvou plynu. Takový povrch má určité vlastnosti, jež jsou však podstatně odlišné od vlastností „čistého" - tj. molekulárně čistého - povrchu. Právě vlastnosti molekulárně čistých povrchů jsou velmi důležité a jsou i technicky významné (např. pro mikroelektroniku). Zcela čistý povrch (tj. takový, při něnž je Ns = 0) je ovšem prakticky nerealizovatelný. Za prakticky čistý povrch považujeme takový, při němž je Ns adsorbovaných molekul značně menší než hustota
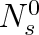 monomolekulární vrstvy.
monomolekulární vrstvy.
Připravit čistý povrch je možno různým způsobem. Každý z nich však musí být prováděn tak, aby během přípravy a i v další době nemohlo nastat znečištění. Zmíníme se jen o některých ze způsobů přípravy čistého povrchu: 1. Odstraněním adsorbovaných molekul bombardováním elektrony nebo ionty. Tyto částice udílejí přitom adsorbovaným molekulám takovou energii, že se uvolní z vazby na povrchu a desorbují. 2. Odplynění adsorbovaných molekul zahřátím látky na vysokou teplotu. 3. Odštípnutím povrchové vrstvy látky společně s adsorbovanou vrstvou. Tím se připraví nový povrch pevné látky.
Všechny tyto způsoby přípravy čistého povrchu se musí provádět při tak nízkém tlaku, aby se povrch znovu neznečistil. Důležitou charakteristikou pro uchování čistého povrchu je doba tvorby monomolekulární vrstvy t+. Předpokládejme, že na počátku máme ve vakuovém systému povrch zcela zbavený adsorbovaných molekul a uvažovaným podmínkám odpovídající hustota monomolekulární vrstvy je
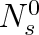 . Je-li každá molekula, která dopadne na povrch, adsorbována, je doba t+ rovna poměru
. Je-li každá molekula, která dopadne na povrch, adsorbována, je doba t+ rovna poměru
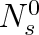 k počtu molekul dopadajících na povrch N, tj.
k počtu molekul dopadajících na povrch N, tj.
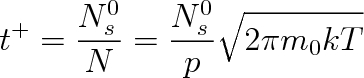 |
(6.25) |
Pro vzduch za normální teploty a pro
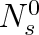 = 1015 cm-2 je
= 1015 cm-2 je
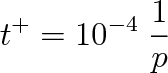 |
(6.26) |
U uvedeného je zřejmé, že doba t+ je velmi krátká a že teprve při nízkých tlacích je tak dlouhá, že můžeme během části doby t < t+ počítat s povrchem jako prakticky čistým. Tak jsme se dostali k nové podmínce pro nízké tlaky, jež je definována prostřednictvím doby t+. Této podmínce říkáme ultravakuová a vakuové systémy ji splňující nazýváme ultravakuové systémy.