Již jsme se zmiňovali o existenci vzájemného silového působení mezi molekulami. Započítáním této interakce jsme přešli od stavové rovnice ideálního plynu (7.1) k přesnější van der Waalsově rovnici, např. (7.2a). Vliv mezimolekulárních sil je však ve van der Waalsově rovnici zahrnut jen poloempiricky prostřednictvím konstant a, b.
Všechny mezimolekulové síly mají svůj původ v elektrických silách. Atom či molekula však představuje složitý elektrodynamický systém. Kladně nabitá jádra jsou obklopena záporně nabitými elektrony. Při vzájemném přiblížení dvou molekul pak mezi sebou působí elektronové obaly i kladně nabitá jádra obou molekul.
Uvažujeme-li pouze molekuly s celkovým nábojem rovným nule, mohou nastat následující interakce:
1. Interakce mezi permanentními dipólovými momenty molekul.
2. Interakce mezi permanentním dipólovým momentem a dipólovým momentem, který tato molekula indukuje v druhé molekule.
3. Interakce mezi atomy nebo molekulami, jež nemají dipólový moment. Tato interakce přichází v úvahu u vzácných plynů nebo u molekul jim podobných.
4. Překryvové interakce. Prvé tři interakce vedou k přitahování molekul, poslední k jejich vzájemnému odpuzování. Síly, které vyvolávají tyto interakce, se nazývají van der Waalsovy síly.
Permanentní dipólový moment mají molekuly s nesouměrně rozloženým nábojem. Tyto molekuly se nazývají polární a budí kolem sebe pole podobné poli elementárního dipólu. Velikost intenzity tohoto pole se zmenšuje nepřímo úměrně třetí mocnině vzdáleností (E ~ r-3).
Potenciální
energie dvou vzájemně na sebe působících elementárních dipólů s dipólovými momenty
 a
a
 je rovna
je rovna
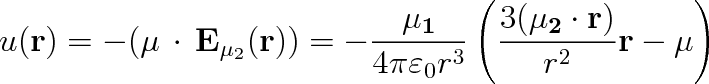 |
Zde znamená r vektor určující vzájemnou polohu dipólů. Vykonávají-li molekuly tepelný pohyb, je výpočet energie u(r) poněkud komplikovanější. Musíme použít statistických metod a najít střední hodnotu této energie. Příslušný výpočet vede ke vztahu
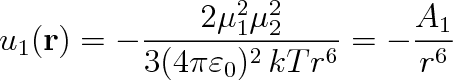 |
(7.22) |
Člen kT charakterizuje energii tepelného pohybu. Vystupuje ve výrazu proto, že dva volně se pohybující dipóly mohou být orientovány tak, že se přitahují nebo odpuzují. V důsledku tepelného pohybu se tyto dvě možnosti střídají. Čím nižší je teplota plynu, tím je tepelný pohyb méně intenzívní a převažuje přitažlivé působení.
Z mechaniky je známo, že síla je rovna gradientu potenciální energie, (F = - grad u(r)). Velikost přitažlivé síly mezi dvěmi polárními molekulami bude tedy úměrná r-7. Zmenšuje se tedy podstatně rychleji se vzdáleností než Coulombovská síla mezi dvěma náboji, která je úměrná r-2. Van der Waalsova síla je silou krátkého dosahu.
Ve vzorci (7.22) je však zahrnuta jen interakce dipólových momentů, které mají molekuly i tehdy, nejsou-li v elektrickém poli (permanentních dipólových momentů). Polární molekuly vytváří kolem sebe elektrické pole, v němž se polarizuje sousední molekula, přiblíží-li se dostatečně blízko. Tuto polarizaci charakterizuje koeficient polarizovatelnosti
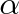 , který je v prvém přiblížení tím větší, čím větší je molekula. Kolem roku 1920 ukázal P. Debye, Nizozemec (1884-1966), že při přiblížení dvou molekul s dipólovými momenty
, který je v prvém přiblížení tím větší, čím větší je molekula. Kolem roku 1920 ukázal P. Debye, Nizozemec (1884-1966), že při přiblížení dvou molekul s dipólovými momenty
 a
a
 a polarizovatelnostmi
a polarizovatelnostmi
 a
a
 , se potenciální energie párového působení ještě zvýší o hodnotu
, se potenciální energie párového působení ještě zvýší o hodnotu
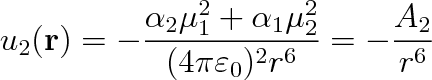 |
(7.23) |
Tento vzorec platí i v případě, setkají-li se dvě stejné polární molekuly (
 ,
,
 ), nebo polární molekula s nepolární
), nebo polární molekula s nepolární
 , což odpovídá druhému případu mezimolekulárni interakce.
, což odpovídá druhému případu mezimolekulárni interakce.
Vyčíslení interakční energie mezi dvěmi nepolárními molekulami je možno provést pouze v rámci kvantové mechaniky. Tento výpočet provedl r. 1930 F. London (americký fyzik němec, původu, 1900-1954) a došel k výrazu
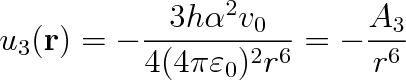 |
(7.24) |
ve kterém h je Planckova konstanta a v0 je frekvence. Význam ostatních symbolů je stejný jako ve vztahu (7.22). Tato interakce se nazývá disperzní.
Abychom upřesnili význam veličiny v0, uvedeme zde alespoň přibližné vysvětlení této interakce . Vychází se z představy, že rozdělení hustoty náboje v elektronovém obalu atomu je časově proměnné. Říkáme-li například, že rozložení náboje v atomu je kulově symetrické, rozumíme tím, že kulově symetrická je střední hustota náboje, počítaná přes poměrně dlouhý časový interval. V každém okamžiku je však tato symetrie poněkud porušena. Znamená to, že i molekuly, o nichž říkáme, že jsou kulově symetrické, mají dipólový moment, jehož směr a velikost se ovšem rychle mění. Jeho střední hodnota bude samozřejmě rovna nule. Takto se chovající atom budí ve svém okolí časově proměnné elektrické pole, kterým působí na sousední atomy. Mžikový dipólový moment indukuje v nejbližších sousedech dipólové momenty, o nichž lze dokázat, že jsou orientovány tak, že dochází k přitahování atomů. Dochází tedy k interakci mezi mžikovým dipólovým momentem atomu a produkty jeho polarizačních účinků. Výsledkem je časově závislá síla, která reprezentuje vazbu mezi dvěma oscilátory. Přísluší jí střední hodnota potenciální energie vyjádřená vztahem (7.24). Frekvence v0 charakterizuje kmity takto spřažených oscilátorů. Lze ji stanovit jako poměr nejmenší energie I potřebné k ionizaci atomu a Planckovy konstanty h, v0 = I/h.
Tabulka 7-3 Hodnoty koeficientů určujících mezimolekulárni interakci
|
Molekula |
A1* . 1079 (J . m6)
|
A2 . 1079 (J . m6)
|
A3 . 1079 (J . m6)
|
|
He |
0 |
0 |
1,2 |
|
Xe |
0 |
0 |
217 |
|
CO |
0,003 4 |
0,057 |
67,5 |
|
NH3 |
84 |
10 |
93 |
|
H20 |
190 |
10 |
47 |
*) pro teplotu T = 293 K
V tabulce 7-3 uvádíme příspěvky k mezimolekulární interakci stanovené Butlerem v roce 1937. Veličiny A1 až A3, které jsme zavedli rovnicemi (7.22) až (7.24), jsou nepředstavitelně malé, v průměru řádu 10-79. Musíme si však uvědomit, že mezimolekulární síly se projevují při vzdálenostech řádu 10-10 m. Ve výrazech (7.22) až (7.24) jsou veličiny A1 děleny šestou mocninou vzdálenosti. Molární energie plynu už potom nejsou zanedbatelné. Z dat uváděných v tabulce 7-3 je zřejmé, že s výjimkou silně polárních molekul, jako je například voda, největší příspěvek k mezimolekulárnímu silovému působení přinášejí disperzní síly. Nejmenšími silami na sebe působí atomy helia. To je příčinou, že helium přechází do kapalného skupenství při extrémně nízké teplotě (~ 4K).
Zbývá ještě pojednat o poslední interakci, která se nazývá překryvová interakce. Při dostatečně malé vzdálenosti molekul dojde k vzájemnému překryvu elektronových obalů. Interakce mezi souhlasnými náboji vede ke vzniku silných odpudivých (repulsních) sil. Kromě odpudivých sil se podstatně slaběji uplatňují i přitažlivé síly mezi elektronovým obalem jedné molekuly a kladně nabitými jádry druhé molekuly. Přesný výpočet je nesmírně komplikovaný. Dokazuje se, že potenciální energii odpudivých sil lze popsat výrazem
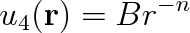 |
(7.25) |
kde n je přirozené číslo rovné nejméně devíti.
Z předchozích úvah vyplývá, že potenciální energii interakce dvou molekul lze vyjádřit jako rozdíl dvou členů
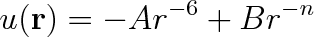 |
(7.26) |
Tento výraz vyjadřuje takzvaný párový mezimolekulární potenciál.
Jedná se opět o zjednodušené vyjádření. Výsledná energie závisí pouze na vzdálenosti r molekul. Ve výrazu (7.26) není zachycena závislost párového potenciálu na vzájemné orientaci dvou nesymetrických molekul.
Schématicky je průběh párového mezimolekulárního potenciálu na obr. 7-7.
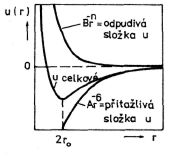 Obr. 7-7
Obr. 7-7
Odpudivé síly převládají až do vzdálenosti r = 2r0, při které je energie párové interakce minimální. Hloubka minima však pro látky v plynném stavu není dostatečná k tomu, aby se molekuly udržely pohromadě. Teprve snížením teploty, zmenšením energie tepelného pohybu kT, můžeme dosáhnout přechodu do kapalného nebo pevného skupenství.
O výrazech tohoto druhu se mluví jako o Lennard-Jonesových potenciálech. Nejběžněji se volí n = 12, výraz se zapisuje ve tvaru
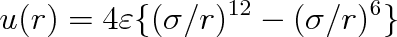 |
(7.31) |
a nazývá se Lennard-Jonesův 6-12 potenciál. V předchozím vztahu znamená e hloubku potenciálové jámy. Potenciální energie u(r) dosahuje nejmenší hodnoty rovné
 , jsou-li středy molekul vzdáleny o
, jsou-li středy molekul vzdáleny o
 . Vzdálenost r0 můžeme považovat za průměr molekuly. V této vzdálenosti na sebe molekuly silově nepůsobí, neboť síla F = -(du(r)/dr) je v minimu funkce u(r) rovna nule. Pro plyny musí být energie e menší, než energie tepelného pohybu molekul kT. Jinak by látka přešla do kondenzovaného stavu.
. Vzdálenost r0 můžeme považovat za průměr molekuly. V této vzdálenosti na sebe molekuly silově nepůsobí, neboť síla F = -(du(r)/dr) je v minimu funkce u(r) rovna nule. Pro plyny musí být energie e menší, než energie tepelného pohybu molekul kT. Jinak by látka přešla do kondenzovaného stavu.
Lennard-Jonesův 6-12 potenciál je výbornou aproximací pro popis silového působení nepolárních molekul. Pro několik plynů jsou průběhy funkce (7.31) zakresleny na obr. 7-10. Vidíme, že energie s jsou řádu tisícin až desetin elek-tronvoltu (1 eV
 1,6 . 10-19 J), vzdálenosti r0 řádu 10-10 m.
1,6 . 10-19 J), vzdálenosti r0 řádu 10-10 m.
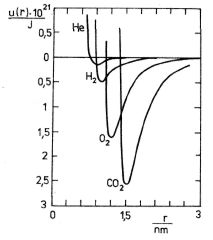 Obr. 7-10
Obr. 7-10