Jednou z možností, jak přímo prokázat existenci mezimolekulárních sil, je Joulův-Thomsonův jev. Je modifikací Gay-Lussacova pokusu. Z Gay-Lussacova pokusu vyplynulo, že plyn po expanzi do vakua nezmění svou teplotu. Při přesnějším měření se však ukázalo předchozí tvrzení jako nepravdivé.
 Obr. 7-11
Obr. 7-11
Joule a Thomson (1852) opakovali Gay-Lussacova měření v uspořádání, které umožňovalo přesnější měření teploty. Plyn protlačovali přes pórovitou přepážku s (obr. 7-11) s malou tepelnou vodivostí. Tato přepážka, kterou tvořila v Joulově a Thomsonově uspořádání destička z mořské pěny, zaškrcovala proud plynu natolik, že na levé a pravé straně přepážky byl výrazně rozdílný tlak. Pohyb pístů A a B umožňoval udržet tlaky p1 a p2 vlevo a vpravo od přepážky konstantní. Celé zařízení bylo adiabaticky izolováno.
Předpokládejme, že na začátku pokusu byl veškerý plyn na levé straně nádoby a zaujímal objem V1 při tlaku p1 a teplotě T1 (viz obr. 7-11a). Silovým působením na píst A přetlačíme plyn do druhé části nádoby. Na píst B působí taková síla, aby tlak v pravé části nádoby byl p2. Je-li p2 < p1, je F1 > F2 a plyn zaujme po průchodu přepážkou objem V2 > V1. Dojde k adiabatické expanzi plynu. Pro změnu vnitřní energie plyne z prvního termodynamického zákona, že
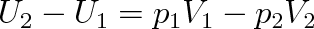 |
Přeskupíme-li členy v této rovnici tak, aby na každé straně byly veličiny se stejným indexem, vidíme, že se jedná o děj, při kterém se nemění entalpie systému:
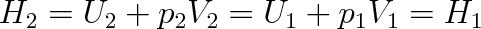 |
Pro ideální plyn je vnitřní energie U a podle stavové rovnice i veličina p V úměrná teplotě. Nemění-li se teplota, bude platit, že U1 = U2 a p1V1 = p2V2. Práce W1 = P1V1, kterou vykonala síla působící na levý píst, se rovná práci W2, potřebné na zvětšení objemu plynu za přepážkou, W2 = p2V2. Tento výsledek je snadno pochopitelný pro ideální plyn, neboť neuvažujeme působení vnitřních sil, takže energie plynu nezávisí na průměrné vzdálenosti molekul.
Přesná měření však ukázala, že teplota plynu se při této izoentalpické expanzi obecně mění. Kvantitavně se změna teploty reálného plynu charakterizuje Joulovým-Thomsonovým koeficientem
 definovaným jako poměr změny teploty ku změně tlaku, tj.
definovaným jako poměr změny teploty ku změně tlaku, tj.
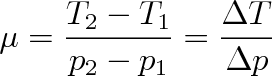 |
Joulův-Thomsonův koeficient může být buď kladný, ochlazuje-li se plyn při snížení tlaku (T1 > T2), nebo záporný, dojde-li k jeho ohřevu (T1 < T2). U každého plynu existuje inverzní teplota Ti, při které koeficient
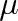 mění znaménko. Inverzní teplota závisí především na druhu plynu, je však i funkcí jeho tlaku.
mění znaménko. Inverzní teplota závisí především na druhu plynu, je však i funkcí jeho tlaku.
Vysvětlení Joulova-Thomsonova jevu souvisí bezprostředně s existencí mezi-molekulárních sil. Při expanzi plynu se mění vzdálenost mezi molekulami a je nutno vykonat určitou práci W = W2 - W1 proti silám vzájemného působení
molekul. Tato práce může být buď kladná, nebo záporná a způsobí změnu vnitřní energie plynu.
Přibližný výpočet Joulova-Thomsonova koeficientu vycházející (viz např. [12]) z předpokladu, že plyn se řídí van der Waalsovou stavovou rovnicí a tlak plynu není extrémně velký (< 10 MPa), vede k výrazu
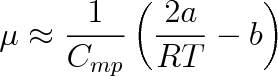 |
v němž a, b jsou van der Waalsovy koeficienty, Cmp molární tepelná kapacita při konstantním tlaku, T termodynamická teplota a R molární plynová konstanta. Při inverzní teplotě bude
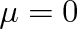 , takže
, takže
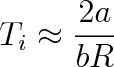 |
Inverzní teplotu můžeme též vyjádřit pomocí kritické teploty, dosadíme-li do předchozího vztahu podle (7.10). Dostaneme, že
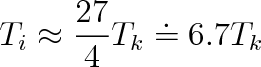 |
Z posledního vztahu vyplývá, že inverzní teplota bude tím nižší, čím nižší je kritická teplota. I když odvození předchozích výrazů bylo velmi hrubé, experiment tyto výsledky relativně dobře potvrzuje. Pro kyslík je Ti = 893 K při kritické teplotě 154 K, pro vodík a helium Ti = 205 K a 40 K při kritických teplotách Tk = 33 K a 5,2 K. Takže pro kyslík, vodík a helium je postupně Ti(O2) = 5,8 Tk, Ti(H2) = 5,1 Tk, Ti(He) = 6,3 Tk.