Kapaliny, látky kapalného skupenství, tvoří přechod mezi látkami skupenství pevného a plynného. Skládají se z molekul, které jsou v neustálém a neuspořádaném pohybu. O tomto tepelném pohybu svědčí jevy, jako je např. difúze kapalin nebo pohyb Brownovy částice v pozorované kapalině (viz 1. kapitola). Protože s rostoucí teplotou probíhá difúze kapalin rychleji, popřípadě střední rychlost Brownovy částice v kapalině roste, je na první pohled tepelný pohyb molekul kapaliny podobný tepelnému pohybu částic plynu. Tento názor podporuje i makroskopické hledisko, že kapaliny a plyny jsou tekutinami a že při kritické teplotě mizí rozhraní mezi kapalinou a její sytou párou. Na rozdíl od plynů nemá však střední kinetická energie molekul kapaliny zřejmě takovou hodnotu, aby se molekuly kapaliny rozlétly do volného prostoru.
Ukazuje se však, že tepelný pohyb molekul kapaliny se značně liší od tepelného pohybu částic plynu v důsledku poměrně složité struktury kapaliny. Podle současné teorie se kapalina skládá z malých skupin molekul. V každé skupině jsou spolu molekuly vázány a pravidelně uspořádány. Jednotlivé skupiny jsou však rozloženy zcela nepravidelně a vzájemně jsou odděleny oblastmi, mezi nimiž se molekuly pohybují chaoticky. V kapalině je tedy takové uspořádání částic, které představuje stav ležící mezi naprostým neuspořádáním částic plynu a plným uspořádáním částic v ideálních krystalech. Toto uspořádání se označuje jako krátkodosahové uspořádání na rozdíl od dalekodosahového uspořádání u krystalů pevných látek.
Tabulka 9-1 Hustoty některých látek v různých skupenstvích
|
Látka |
Hustota (kg . m-3) |
|||
|
pev |
né skupenství |
kapalné skupenství |
plynné skupenství |
|
|
argon |
1 650 |
(při -233 °C) |
1 401 (při -186 °C) |
1,784 |
|
vodík |
81 |
(-262 °C) |
71 (-253 °C) |
0,090 |
|
dusík |
1 026 |
(-252 °C) |
808 (-196°C) |
1,250 za 1 429 normál. 3;214 podm. |
|
kyslík |
1 460 |
(-253 °C) |
1 132 (-183 °C) |
|
|
chlór |
1 900 |
(-35 °C) |
1568 (-10°C) |
|
|
voda |
917 |
(0°C) |
999,9 (0 °C) |
0,005 |
S velkou hustotou souvisí nepatrná stlačitelnost pevných a kapalných těles. Součinitel stlačitelnosti y kapalin je zpravidla nepatrně větší než součinitel stlačitelnosti pevných látek*. Např. pro vodu při teplotě 4 °C je
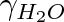 = = 4.8 . 10-10 Pa-1, pro led H20 při 0 °C je $gamma_{rm led} = 1,1 . 10-10 Pa-1.
= = 4.8 . 10-10 Pa-1, pro led H20 při 0 °C je $gamma_{rm led} = 1,1 . 10-10 Pa-1.
Malou rozdílnost mezi kapalnou a pevnou látkou v okolí teploty tání ukazují také hodnoty molární tepelné kapacity. Z tabulky 9-2 je patrné, že hodnoty této veličiny (např. při konstantním tlaku) lze pro některé prvky v kapalném a pevném skupenství považovat za prakticky stejné.
Tabulka 9-2 Molární tepelné kapacity cp
|
Pevné skupenství |
Teplota tání (°C) |
Kapalné skupenství |
|||
|
teplota (°C) |
molární tepelná kapacita (J . mol-1 . K-1) |
teplota (°C) |
molární tepelná kapacita (J . mol-1 . K-l) |
||
|
sodík |
25 |
28,12 |
97,8 |
98 |
31,87 |
|
draslík |
63 |
30,36 |
63,6 |
70 |
34,44 |
|
zinek |
419 |
30,10 |
419,6 |
420 |
33,12 |
|
stříbro |
600 |
28,68 |
961,9 |
1 100 |
33,79 |
|
rtuť |
-42 |
27,63 |
-38,9 |
0 |
28,01 |
|
olovo |
300 |
29,30 |
327,5 |
328 |
25,22 |