Mějme měřenou látkou částečně naplněn kalorimetr. Předpokládejme, že vnitřek kalorimetru můžeme vyhřívat například elektrickým proudem s konstantním příkonem. Je-li kalorimetr dobře izolován od okolí, a jeho stěny mají zanedbatelně malou tepelnou kapacitu, přemění se veškerá elektrická energie, dodaná do kalorimetru, na vnitřní energii měřené látky, což se projeví ohřátím a skupenskými přeměnami látky.
Pokud měřená látka byla na počátku ohřevu v pevném stavu, bude mít časová závislost teploty uvnitř kalorimetru obdobný průběh jako křivka na obrázku 8-2. Na tomto obrázku jsme měřítka na souřadnicových osách volili tak, že průběh grafu odpovídá ohřevu ledu o hmotnosti 1 kg, výchozí teplotě -20 °C a příkonu 1 kW. Dosáhne-li teplota ledu hodnoty 0 °C, vzrůst teploty se zastaví a led začne tát. Při ideálním přestupu tepla mezi topnou spirálou a ledem zůstane teplota konstantní, dokud všechen led neroztaje. Měrné skupenské
 Obr. 8-2
Obr. 8-2
teplo tání vody je 334 kJ . kg-1, takže při zvoleném příkonu a hmotnosti ledu bude časová prodleva činit 334 s. Pak teplota začne opět růst, ovšem strmost křivky v intervalu teplot 0 °C až 100 °C bude poloviční než při teplotách pod 0 °C. Je to způsobeno tím, že měrná tepelná kapacita vody je přibližně dvojnásobná (~ 4,2 kJ . kg-1 . K-1)než ledu (~ 2,1 kJ . kg-1 . K-1). Dosáhne-li teplota vody hodnoty 100 °C, začne při normálním atmosférickém tlaku voda vřít. Dochází k přeměně kapaliny v páru (varem) a teplota soustavy zůstává konstantní, pokud se nemění tlak v soustavě. Teplota by se dále zvyšovala teprve až po přechodu veškeré kapaliny do plynného skupenství. U vody hmotnosti 1 kg je třeba k této skupenské přeměně dodat teplo přibližně 2,5 MJ.
Abychom mohli do grafu na obr. 8-2 zakreslit ukončení vypařování, museli bychom podstatně změnit měřítko na vodorovné ose. Prodleva teploty by trvala asi 2500 s, byla by tedy asi 7 krát delší, než u tání ledu.
Skupenská tepla vypařování Lv jsou závislá na teplotě. S rostoucí teplotou klesají a při kritické teplotě, kdy mizí rozdíl mezi kapalinou a její párou, je Lv = 0. Dodané skupenské teplo se spotřebuje jednak na zvýšení vnitřní energie soustavy (vnitřní skupenské teplo Lvi), jednak na práci, kterou vykoná plyn při zvětšení objemu páry vůči objemu kapaliny (vnější skupenské teplo Lve). Vnější skupenské teplo je podstatně menší než vnitřní. Jako příklad jsou v tabulce 8-2 uvedena celková vnitřní i vnější měrná skupenská tepla vypařování vody při různých teplotách.
Tabulka 8-2 Vnitřní a vnější měrná skupenská tepla vypařování vody
|
Teplota |
Měrné skupenské teplo vypařování |
||
|
vnitřní |
vnější |
celkové |
|
|
T(K) |
li(kJ.kg-1) |
lv(kJ.kg-1) |
l(kJ.kg-1) |
|
273,15 373,15 473,15 573,15 647,3 |
2 374 2 086 1 744 1 233 0 |
126 170 198 171 0 |
2 500 2 256 1 942 1 404 0 |
Zvláštním případem vypařování je var. K varu kapaliny dojde tehdy, je-li tlak syté páry uvnitř bublin roven vnějšímu tlaku nad kapalinou. Ke skupenské změně kapaliny v páru pak dochází i uvnitř kapaliny, nejen na jejím povrchu. V tabulce 8-3 uvádíme pro několik běžných látek normální teploty varu a hodnoty měrného skupenského tepla varu l'v.
Opačným dějem k vypařování je kondenzace, při které pára v důsledku její komprese nebo snížením teploty kapalní. Při kondenzaci se zpětně uvolňuje
skupenské teplo kondenzační stejně velké jako skupenská teplo vypařování (pro tutéž teplotu). Skupenská tepla se proto nazývají latentními, můžeme je získat zpět.
Prodleva ve zvyšování teploty při skupenské přeměně pevné látky v kapalinu (viz obr. 8-2) se projeví pouze při ohřívání krystalických látek. U látek amorfních
Tabulka 8-3 Teploty normálního bodu varii a měrných skupenských tepel varu
|
Látka |
Teplota varu |
Měrné skup. teplo varu |
|
rv(K) |
Ukj.kg-1) |
|
|
helium |
4,216 |
20,6 |
|
vodík |
20,28 |
454 |
|
dusík |
77,348 |
198 |
|
kyslík |
90,118 |
213 |
|
čpavek |
195,45 |
1 370 |
|
etylalkohol |
351,48 |
840 |
|
voda |
373,15 |
2 256 |
|
rtuť |
629,81 |
292 |
|
hliník |
2 740 |
10 500 |
|
cín |
2 993 |
1 940 |
|
železo |
3 023 |
6 340 |
|
uhlík |
4 091 |
nelze tuto prodlevu pozorovat. Při ohřevu amorfní látky v kalorimetru s konstantním příkonem bychom naměřili pouze více či méně výraznou změnu směrnice grafu závislosti času na teplotě.
Tabulka 8-4 Teploty tání a měrná skupenská tepla tání
|
Teplota tání |
Měrné skupenské teplo tání |
|
|
Tt(K) |
lt(kJ . kg-1) |
|
|
helium |
1,15* |
5,2 |
|
vodík |
14,0 |
58,2 |
|
dusík |
63,32 |
25,5 |
|
etylalkohol |
158,65 |
108 |
|
rtuť |
234,288 |
11,8 |
|
voda |
273,15 |
333,7 |
|
cín |
505 |
15,8 |
|
zinek |
692,73 |
102 |
|
stříbro |
1 235,08 |
111 |
|
zlato |
1 337,58 |
64 |
* při tlaku > 2,5 MPa
Dodání skupenského tepla tání je spojeno s narušením krystalové mřížky látky. Pokud je látka amorfní, skupenské teplo tání je malé. V tabulce 8-4 uvádíme měrná skupenská tepla tání a teploty tání pro několik látek. Tlak syté páry nad pevnou látkou je sice podstatně menší než nad kapalinou, zůstává však nenulový. Znamená to, že za teploty menší než teplota tání přechází látka přímo z pevného do plynného skupenství. Tomuto jevu říkáme sublimace. Stejně jako při vypařování musíme látce dodávat skupenské teplo. Pro vodu (led) hmotnosti 1 kg je Ls = 2,8 MJ při teplotě 0 °C. Obecně je skupenské teplo sublimační rovno součtu skupenských tepel tání a vypařování (pro tutéž hmotnost), tedy
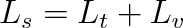 |
(9.11) |