Stavovou rovnicí rozumíme analytický vztah mezi stavovými veličinami. V rovnovážném stavu určují jednoznačně stav jednosložkového plynu libovolné dvě ze tří stavových veličin, kterými jsou teplota, tlak a objem. Používání stavových rovnic ulehčuje výpočet termodynamických veličin, např. entropie, entalpie atd., neboť potřebné derivace a integrace lze provádět analyticky.
Zatím jsme se setkali s jedinou stavovou rovnicí - stavovou rovnicí ideálního plynu, která má pro plyn o látkovém množství 1 mol tvar (viz 2.18))
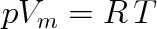 |
(7.1) |
Tato rovnice vznikla spojením dvou empirických vztahů, zákona Boyleova--Mariottova a zákona Gay-Lussacova, které jsou dobře splněny jen v silně zředěných plynech. Nelze proto tuto stavovou rovnici považovat za obecně platnou. Stavovou rovnici (7.1) lze odvodit ze základních představ kinetické teorie plynů (viz kap. 5). Jedním ze základních předpokladů této teorie je, že molekuly na sebe mimo okamžik srážky silově nepůsobí , avšak bez přitažlivých mezimolekulárních sil by nemohl existovat kapalný a pevný stav látky, molekuly by byly vždy nahodile rozmístěny v celém jim dostupném prostoru. Musí se však uplatňovat i odpudivé síly, klesne-li vzdálenost molekul pod určitou mez, za kterou můžeme považovat průměr molekuly. Jinak by se všechny molekuly smrštily do jediného bodu. Velikost přitažlivých sil se musí zmenšovat s rostoucí vzdáleností molekul, což je nutná podmínka pro existenci plynného stavu látky.
Představa o plynu, jako soustavě vzájemně na sebe silově nepůsobících hmotných bodů, je jen první aproximací, která dobře souhlasí s výsledky experimentů při malých hustotách plynů (při velkých mezimolekulárních vzdálenostech).
Jako jeden z prvních se otázkou zpřesnění stavové rovnice (7.1) zabýval J. D. van der Waals (Nizozemec, 1837-1923). Jeho úvaha vycházela z představy, že v rovnici (7.1) je nutno molární objem Vm zmenšit minimálně o vlastní objem
molekul v počtu {NA} a tlak p plynu korigovat o takzvaný kohézní tlak pi, který je vyvolán přitažlivými silami molekul.
Uvnitř nádoby je výslednice přitažlivých sil okolních molekul působících na vybranou molekulu nulová. V mezní vrstvě u stěny nádoby však převládají síly
 Obr. 7-1
Obr. 7-1
směřující dovnitř nádoby. Odhaduje se, že kohézní tlak je jednak úměrný počtu molekul v mezní vrstvě, jednak počtu molekul v podpovrchové vrstvě plynu sousedící s mezní vrstvou (viz obr. 7-1). Počty molekul v obou vrstvách pokládáme za stejné a nepřímo úměrné molárnímu objemu plynu Vm. Kohézní tlak bude úměrný součinu počtu molekul v obou vrstvách, a tím i
 . Takže položíme
. Takže položíme
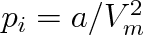 . Dostaneme tak van der Waalsovu rovnici odvozenou r. 1873, kterou zapíšeme pro 1 mol plynu ve tvaru
. Dostaneme tak van der Waalsovu rovnici odvozenou r. 1873, kterou zapíšeme pro 1 mol plynu ve tvaru
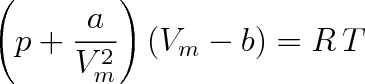 |
(7.2a) |
Veličiny a, b vystupující v rovnicích (7.2a, b) by měly být charakteristickými konstantami pro jednotlivé plyny. Veličina a souvisí s přitažlivými, veličina b s odpudivými silami. K jejich interpretaci pomocí jednoduchých strukturních modelů mezimolekulárního silového působení se vrátíme v článku 7.5.
Výše uvedený postup je typickou ukázkou semiempirického přístupu, který se ve fyzice často používá a je mimořádně cenný pro zpracování experimentálních dat v případech, ve kterých je exaktní řešení obtížné. Rovnice (7.2a, b) sice vystihují naměřená data lépe než stavová rovnice (7.1), to však není nic překvapivého, neboť rovnice (7.2a, b) obsahují dva nastavitelné parametry (a, b). Tyto parametry však nejsou podrobněji strukturně interpretovány. Pro empirickou rovnici lze stanovit meze její platnosti jen porovnáním s experimentem.
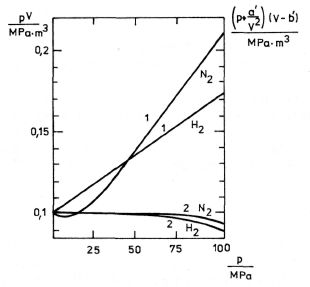
Souhlas experimentálních dat s rovnicemi (7.1) a (7.2a, b) ilustrujeme na obr. 7-2. Kdyby se reálný plyn přesně řídil některou z těchto stavových rovnic, musel
 Obr. 7-2
Obr. 7-2
by součin pV, respektive (p + an2/V2) (V - nb) zůstat při dané teplotě konstantní a rovný hodnotě nRT, a to nezávisle na stlačení plynu. Hodnoty tlaku p a objemu V, naměřené při teplotě 273 K pro vodík a dusík, jsou dosazeny do rovnic (7.1), křivky 1, a (7.2b), křivky 2. Počáteční objem plynů byl 1 m3 při tlaku 0,1 MPa, takže hodnota nRT = 0,1 MPa . m3. Při tlaku 100 MPa jsou však hodnoty součinu pV přibližně dvojnásobné. Použijeme-li ke zpracování dat rovnici (7.2b), je souhlas o více než řád lepší (odchylka při 100 MPa je 9 % pro H2 a 4,5 % pro N2).
Odchylky mezi experimentálními daty a hodnotami vypočtenými ze stavových rovnic (7.1) i (7.2a, b) zůstávají poměrně velké. To vedlo řadu autorů k hledání lépe vyhovujících stavových rovnic.
Jako ukázku uvedeme dvě další stavové rovnice:
a) Předpokládáme-li, že člen ve van der Waalsově rovnici vyjadřující kohézní tlak je nepřímo úměrný teplotě, dostaneme Berthelotovu rovnici
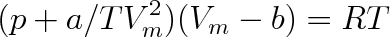 |
(7.3) |
Rovnice pochází z roku 1900 a je poněkud přesnější než rovnice (7.2b).
b) Za nejpřesnější dvouparametrovou stavovou rovnici je považována rovnice navržená v roce 1948 Redlichem a Kwongem
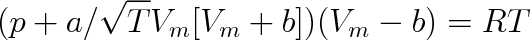 |
(7.4) |
Uvádí se, že tato rovnice vystihuje skutečný vztah mezi stavovými veličinami lépe, než řada víceparametrových stavových rovnic. Konstanty a, b se pak určují postupnými aproximacemi z naměřených dat.
V dalším výkladu budeme používat především rovnici van der Waalsovu, neboť je relativně jednoduchá. Na ní můžeme nejsnadněji ilustrovat pojmy, které budeme zavádět.